전기화학
전기화학(電氣化學, 영어: electrochemistry)은 물질간의 전자의 이동과 그것들에 의한 여러 현상을 취급하는 화학의 한 분야이다. 물리화학, 분석화학, 화학공학 등과의 연관이 깊다.
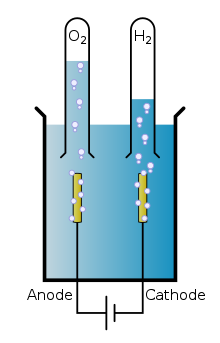
전기화학에서 취급되는 주요 내용은 다음과 같다.
- 전기화학 반응 - 물질간의 전자 이동에 의한 산화·환원 반응과, 그것들에 의한 여러 가지 현상. 주로 전극 - 용액계의 반응. 예로서는 물의 전기 분해 등이 있다.
- 에너지 변환 - 화학 에너지와 전기에너지, 빛에너지 등의 상호변환. 전지와 유기 EL 등.
- 전기화학 측정 - 전도성과 전기용량 등의 거시적인 성질로부터 산화·환원 전위와 전자 이동 속도 등의 미시적인 성질까지 여러 가지 물질의 측정. 유도성 고분자 등.
- 전기화학 분석 - 전기화학적인 반응과 특성을 이용하여 분석하는 방법. 전기영동과 pH센서 등.
- 전기화학공업 - 전극반응을 이용한 공업. 알루미늄과 구리의 제련 등.
역사 편집
전기화학의 역사는 1781년 루이지 갈바니가 동물전기를 발견된 것에서 시작된다. 전기자체는 그 전부터 존재가 확인되어 왔으나 전기가 화학에 관련되어 있다는 가능성을 보여준 것은 그의 이 발견이었다. 그러나 갈바니는 전기가 개구리의 근육에 축적되어 있어 그것이 금속에 접촉되어 전기가 흐른다고 생각하였다. 화학과 전기의 관련성을 발견한 것은 같은 이탈리아인인 알렉산드로 볼타였다. 1799년 볼타는 볼타전지를 발명하고 전기가 이온화 경향이 다른 두 개의 전극 (반드시 금속일 필요는 없다) 와 전해질으로 만들어진 전지에 의해 만들어지는 것을 증명하였다. 또한 1801년 윌리엄 니콜슨과 앤서니 캘러일이 물이 전기에 의해 분해(전기분해)되는 것을 발견하였다.
전기화학반응이 전극의 산화와 환원 경향과 전해질에 관련되어 있다는 것은 그 뒤의 연구로 명확해지고 많은 수의 전지가 개발되었다. 그러면서 마이클 패러데이가 패러데이의 전기분해 법칙을 발견한다. 이 발견으로 물질량은 전기량과 밀접한 관계를 가지고 있는 것이 밝혀지고 화학반응의 이해에 큰 기여를 하게 되었다.
19세기 말에는 열역학의 발전이 전기화학에 큰 영향을 끼쳤다. 네른스트 식이 발표된 것이다. 이에 따라 전기화학반응은 일반 화학반응과 함께 취급할 수 있게 되었다. 전위가 기브스 자유 에너지를 전기량으로 나눈 것이라는 것을 보인 이 식은 전위차가 전기화학반응을 추진시키는 원동력이고 전위차가 없다면 전기화학반응은 일어나지 않는다는 사실의 이론적인 기초가 되었다.
이용 편집
현재 전기화학의 원리를 이용하여 다양한 에너지 저장 및 변화 장치등의 연구에 이용되고 있다.
연료전지 편집
연료전지(燃料電池, Fuel Cell)란 연료와 산화제를 전기화학적으로 반응시켜 화학적 에너지로부터 전기에너지를 발생시키는 장치이다. 이 화학 반응은 촉매층내에서 촉매에 의하여 이루어지며 일반적으로 연료가 계속적으로 공급되는 한 지속적으로 발전이 가능하다.
건전지(배터리) 편집
이 문단은 비어 있습니다. 내용을 추가해 주세요. |
축전지(이차전지) 편집
축전지(storage battery , 蓄電池)는 양극판|전해액|음극판으로 구성되어 있으며 이들의 화학적 작용에 의해 직류 기전력을 발생시킬 수 있도록 만들어진 장치이다. 화학에너지를 전기에너지로 변화시키는 방전과, 전기에너지를 화학에너지로 변화시키는 충전을 반복할 수 있도록 만들어진것을 축전기 또는 2차전지 라고 부른다. 축전기의 종류로는 납축전지와 알칼리 축전지가 있으며 납축전지를 가장 널리 사용하고있다.
커패시터 편집
이 문단은 비어 있습니다. 내용을 추가해 주세요. |
전기분해 편집
전기분해(Electrolysis, 電氣分解)는 산화/환원 반응이 자발적으로 일어나지 않을 때 전기에너지를 인가하여 산화/환원 반응을 강제로 일으켜 물질을 분해하는 것이다. 물을 분해하여 수소와 산소로 나누는 물분해가 대표적이며 고등학교/대학교 과정에서 황산구리의 구리환원반응 등의 많은 전기분해반응이 있다. 물분해는 많은 연구자들이 연구하고 있으며 주로 수소와 산소를 분해할 때 효율적인 촉매연구가 주된 부분이다. 일반적인 전기분해와 광전기분해 두 가지 영역으로 구분되며 광전기분해는 광촉매를 사용하여 수소와 산소를 분리시킨다. 또한 촉매는 고가의 고성능 촉매효율 극대화와 저가 촉매의 최대 성능을 달성하는 두 가지 방향으로 연구가 진행되고 있다. 물분해로 수소를 생성할 때 저가촉매에서 가장 좋은 성능을 나타내는 물질은 몰리브덴, 고가 촉매에서는 백금이며, 산소 생성시 고가 촉매의 경우 귀금속 (백금, 로듐, 루테늄, 팔라듐, 이리듐 등의 백금족 원소)가 효율적이며 저가 촉매의 경우 코발트, 니켈이 효율적이다.
즉, 전기분해는 산화/환원 반응이 자발적으로 일어나지 않는 물질을 전기에너지를 인가하여 반응을 일어나게 하여 물질을 분해하는 것을 말한다.