광계 I
광계 I(光系 I, 영어: photosystem I)은 식물, 조류, 남세균에서 광합성의 명반응에 관여하는 두 가지 광계 중 하나이다. 플라스토사이아닌-페레독신 산화환원효소(영어: plastocyanin–ferredoxin oxidoreductase)라고도 한다. 광계 I[1]은 빛 에너지를 사용하여 플라스토사이아닌에서 페레독신으로 틸라코이드 막을 가로질러 전자의 전달을 촉매하는 내재성 막 단백질 복합체이다. 궁극적으로 광계 I에 의해 전달된 전자는 고에너지 전자 운반체인 NADPH를 생성하는 데 사용된다.[2] 광계 I에 의해 흡수된 광자 에너지는 ATP를 생성하는 데 사용되는 양성자 구동력을 생성한다. 광계 I은 광계 II보다 훨씬 많은 110개 이상의 보조 인자로 구성된다.[3]


역사 편집
광계 I은 광계 II 이전에 발견되었기 때문에 광계 I으로 알려져 있지만, 이후의 실험에서 광계 II가 실질적인 광합성 전자전달계의 첫 번째 효소라는 것이 밝혀졌다. 광계 I은 1950년대에 발견되었지만 이러한 발견의 중요성은 당시에는 인식되지 않았다.[4] 루이스 도이센스(Louis Duysens)는 1960년에 처음으로 광계 I과 광계 II의 개념을 제안했고 같은 해 페이 벤달(Fay Bendall)로 로버트 힐의 제안은 초기 발견을 일련의 광합성 반응에 대한 일관된 이론으로 정립시켰다.[4] 힐과 벤달의 가설은 도이센스와 위트 그룹이 1961년에 수행한 실험에서 나중에 확인되었다.[4]
구성 요소 및 작동 편집
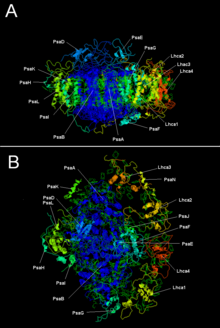
광계 I의 두 가지 주요 소단위체인 PsaA와 PsaB는 중요한 전자전달 보조 인자인 P700, Acc, A0, A1 및 Fx의 결합에 관여하는 밀접하게 관련된 단백질이다. PsaA와 PsaB는 둘 다 11개의 막관통 부분을 포함하는 730~750개의 아미노산으로 구성된 내재성 막 단백질이다. Fx라고 불리는 [4Fe-4S] 철-황 클러스터는 4개의 시스테인에 의해 배위된다. 2개의 시스테인은 PsaA와 PsaB에 의해 각각 제공된다. 각각의 2개의 시스테인은 근위부에 있으며 9번째와 10번째 막관통 부분 사이의 루프에 위치한다. 류신 지퍼 모티프는 시스테인의 하류에 존재하는 것으로 보이며[5] PsaA/PsaB의 이량체화에 기여할 수 있다. 최종 전자 수용체인 FA와 FB(또한 [4Fe-4S] 철-황 클러스터)는 FX 근처의 PsaA/PsaB 코어에 결합하는 PsaC라는 9 kDa 단백질에 위치한다.[6][7]
| 단백질 소단위체 | 설명 |
|---|---|
| PsaA | P700, A0, A1 및 Fx의 결합에 관여하는 관련 대형 막관통 단백질. 광합성 반응 중심 단백질 패밀리의 일부이다. |
| PsaB | |
| PsaC | 철-황 중심, Fa와 Fb에 대한 아포단백질 |
| PsaD | 조립에 필요하며, 페레독신 결합을 돕는다. 인터프로: IPR003685 |
| PsaE | 인터프로: IPR003375 |
| PsaI | PsaL을 안정화할 수 있다. 광수집 복합체 II 결합을 안정화시킨다.[9] 인터프로: IPR001302 |
| PsaJ | 인터프로: IPR002615 |
| PsaK | 인터프로: IPR035982 |
| PsaL | 인터프로: IPR036592 |
| PsaM | 인터프로: IPR010010 |
| PsaX | 인터프로: IPR012986 |
| 사이토크롬 b6f 복합체 | 수용성 단백질 |
| Fa | PsaC로부터, 전자전달계(ETC)에서 |
| Fb | PsaC로부터, 전자전달계에서 |
| Fx | PsaAB로부터, 전자전달계에서 |
| 페레독신 | 전자전달계의 전자 운반체 |
| 플라스토사이아닌 | 수용성 단백질 |
| 지질 | 설명 |
| MGDG II | 모노갈락토실다이글리세라이드 지질 |
| PG I | 포스파티딜글리세롤 인지질 |
| PG III | 포스파티딜글리세롤 인지질 |
| PG IV | 포스파티딜글리세롤 인지질 |
| 색소 | 설명 |
| 엽록소 a | 안테나 시스템의 90개의 색소 분자 |
| 엽록소 a | 전자전달계의 5개의 색소 분자 |
| 엽록소 a0 | 전자전달계의 변형된 엽록소의 초기 전자 수용체 |
| 엽록소 a′ | 전자전달계의 1개의 색소 분자 |
| β-카로틴 | 22개의 카로티노이드 색소 분자 |
| 조효소 및 보조 인자 | 설명 |
| QK-A | 전자전달계의 초기 전자 수용체인 비타민 K1 필로퀴논 |
| QK-B | 전자전달계의 초기 전자 수용체인 비타민 K1 필로퀴논 |
| FNR | 페레독신-NADP+ 환원효소 |
| Ca2+ |
칼슘 이온 |
| Mg2+ |
마그네슘 이온 |
광자 편집
안테나 복합체에 있는 색소 분자의 광여기는 전자 전달과 에너지 전달을 유도한다.[10]
안테나 복합체 편집
안테나 복합체는 두 개의 단백질에 결합된 엽록소와 카로티노이드 분자로 구성된다.[11] 이들 색소 분자는 광여기될 때 광자로부터 공명 에너지를 전달한다. 안테나 분자는 가시광선 내에서 모든 파장의 빛을 흡수할 수 있다.[12] 이러한 색소 분자의 수는 생물체마다 다르다. 예를 들어 남세균인 시네초코쿠스 엘론가투스(Synechococcus elongatus) 또는 테르모신네초코쿠스 엘론가투스(Thermosynechococcus elongatus)는 약 100개의 엽록소와 20개의 카로티노이드를 가지고 있는 반면, 시금치의 엽록체는 약 200개의 엽록소와 50개의 카로티노이드를 가지고 있다.[12][3] 광계 I의 반응 중심 색소는 700 nm의 빛을 가장 잘 흡수하는 엽록소 a인 P700이다. 안테나 분자에 의해 전달되는 에너지는 반응 중심으로 전달된다. P700당 많게는 120개, 적게는 25개의 엽록소 분자가 있을 수 있다.[13]
반응 중심 색소인 P700 편집
반응 중심 색소인 P700은 700 nm 파장의 빛을 가장 잘 흡수하는 변형된 엽록소 a로 구성된다.[14] P700은 안테나 분자로부터 에너지를 받고 각 광자의 에너지를 사용하여 전자를 더 높은 에너지 수준으로 끌어올린다(P700*). 이러한 전자는 P700*에서 전자 수용체로 산화/환원 과정에서 쌍으로 이동하여 P700+를 남긴다. P700*와 P700+의 전위차는 약 −1.2 V이다. 반응 중심은 두 개의 엽록소 분자로 구성되므로 이량체라고 한다.[11] 이량체는 하나의 엽록소 a 분자와 하나의 엽록소 a′ 분자로 구성된 것으로 생각된다. 그러나 P700이 다른 안테나 분자와 복합체를 형성하면 더 이상 이합체가 될 수 없다.[13]
변형된 엽록소 A0 및 A1 편집
두 가지 변형된 엽록소 분자는 광계 I의 초기 전자 수용체이다. 이들은 PsaA/PsaB 측면당 하나씩 존재하며 전자가 Fx에 도달하는 데 사용할 수 있는 2개 분지를 형성한다. A0는 P700*에서 전자를 받아 같은 쪽의 A1으로 전달한 다음 같은 쪽의 퀴논으로 전자를 전달한다. 생물종마다 A/B 가지에 대한 선호도가 다른 것으로 보인다.[15]
필로퀴논 편집
비타민 K1이라고도 불리는 필로퀴논[16]은 광계 I의 다음 초기 전자 수용체이다. 전자를 받기 위해 A1을 산화시키고 Fx에 의해 재산화되어 전자가 Fb와 Fa로 전달된다.[16][17] Fx의 환원은 속도 제한 단계인 것으로 보인다.[15]
철-황 복합체 편집
광계 I에서는 3개의 단백질성 철-황 반응 중심이 발견된다. Fx, Fa, Fb로 표시되어 있으며 전자 중계 역할을 한다.[18] Fa와 Fb는 광계 I 복합체의 단백질 소단위체에 결합되어 있고 Fx는 광계 I 복합체에 묶여 있다.[18] 다양한 실험에서 철-황 보조 인자 배향 이론과 작동 순서 사이에 약간의 차이가 있음이 나타났다.[18] 한 모델에서 Fx는 전자를 Fa로 전달하여 전자가 페레독신으로 전달되도록 한다.[15]
페레독신 편집
페레독신(Fd)은 NADP+를 NADPH로 환원시키는 수용성 단백질이다.[19] 페레독신은 고립된 틸라코이드나 NADP+를 환원시키는 효소로 전자를 전달하기 위해 이동한다.[19] 틸라코이드 막은 Fd의 각 기능에 대해 하나의 결합 부위를 가지고 있다.[19] 페레독신의 주요 기능은 철-황 복합체로부터 페레독신-NADP+ 환원효소로 전자를 운반하는 것이다.[19]
페레독신-NADP+ 환원효소 (FNR) 편집
페레독신-NADP+ 환원효소는 환원된 페레독신의 전자를 NADP+로 전달하여 NADPH로 환원시킨다.[20] 페레독신-NADP+ 환원효소는 NADPH에 결합하여 전자를 받아들일 수도 있다.[20]
플라스토사이아닌 편집
플라스토사이아닌은 사이토크롬 b6f 복합체로부터 광계 I의 P700 반응 중심 색소(이온화된 상태인 P700+)로 전자를 전달하는 전자 운반체이다.[10][21]
Ycf4 단백질 도메인 편집
틸라코이드 막에서 발견되는 Ycf4 단백질 도메인은 광계 I에 필수적이다. 이러한 틸라코이드 막관통 단백질은 광계 I의 구성 요소를 조립하는 데 도움을 준다. 이것이 없으면 광합성은 비효율적이게 된다.[22]
진화 편집
분자 데이터에 의하면 광계 I은 녹색황세균의 광계로부터 진화해왔을 가능성이 크다. 녹색황세균의 광계와 남세균, 조류, 고등 식물의 광계는 동일하지는 않지만 유사한 기능과 유사한 구조를 많이 가지고 있다. 세 가지 주요 특징은 서로 다른 광계 간에 유사하다.[23] 첫째, 산화환원 전위는 페레독신을 환원시킬 수 있을 만큼 음의 값이다.[23] 둘째, 전자 수용 반응 중심에는 철-황 단백질이 포함되어 있다.[23] 셋째, 두 광계 복합체의 산화환원 중심은 단백질 소단위체 이합체 상에 구성된다.[23] 녹색황세균의 광계에는 광계 I의 전자전달계와 동일한 보조 인자가 모두 포함되어 있다.[23] 두 광계 사이의 유사성의 수와 정도는 광계 I과 녹색황세균의 유사한 광계가 공통 조상의 광계로부터 진화해왔음을 강력하게 나타내고 있다.
같이 보기 편집
각주 편집
- ↑ Golbeck JH (1987). “Structure, function and organization of the Photosystem I reaction center complex”. 《Biochimica et Biophysica Acta (BBA) - Reviews on Bioenergetics》 895 (3): 167–204. doi:10.1016/s0304-4173(87)80002-2. PMID 3333014.
- ↑ Yamori W, Shikanai T (April 2016). “Physiological Functions of Cyclic Electron Transport Around Photosystem I in Sustaining Photosynthesis and Plant Growth”. 《Annual Review of Plant Biology》 67: 81–106. doi:10.1146/annurev-arplant-043015-112002. PMID 26927905.
- ↑ 가 나 Nelson N, Yocum CF (2006). “Structure and function of photosystems I and II”. 《Annual Review of Plant Biology》 57: 521–65. doi:10.1146/annurev.arplant.57.032905.105350. PMID 16669773.
- ↑ 가 나 다 Fromme P, Mathis P (2004). “Unraveling the photosystem I reaction center: a history, or the sum of many efforts”. 《Photosynthesis Research》 80 (1–3): 109–24. doi:10.1023/B:PRES.0000030657.88242.e1. PMID 16328814. S2CID 13832448.
- ↑ Webber AN, Malkin R (May 1990). “Photosystem I reaction-centre proteins contain leucine zipper motifs. A proposed role in dimer formation”. 《FEBS Letters》 264 (1): 1–4. doi:10.1016/0014-5793(90)80749-9. PMID 2186925. S2CID 42294700.
- ↑ Jagannathan B, Golbeck JH (April 2009). “Breaking biological symmetry in membrane proteins: the asymmetrical orientation of PsaC on the pseudo-C2 symmetric Photosystem I core”. 《Cellular and Molecular Life Sciences》 66 (7): 1257–70. doi:10.1007/s00018-009-8673-x. PMID 19132290. S2CID 32418758.
- ↑ Jagannathan B, Golbeck JH (June 2009). “Understanding of the binding interface between PsaC and the PsaA/PsaB heterodimer in photosystem I”. 《Biochemistry》 48 (23): 5405–16. doi:10.1021/bi900243f. PMID 19432395.
- ↑ Saenger W, Jordan P, Krauss N (April 2002). “The assembly of protein subunits and cofactors in photosystem I”. 《Current Opinion in Structural Biology》 12 (2): 244–54. doi:10.1016/S0959-440X(02)00317-2. PMID 11959504.
- ↑ Plöchinger, Magdalena; Torabi, Salar; Rantala, Marjaana; Tikkanen, Mikko; Suorsa, Marjaana; Jensen, Poul-Erik; Aro, Eva Mari; Meurer, Jörg (September 2016). “The Low Molecular Weight Protein PsaI Stabilizes the Light-Harvesting Complex II Docking Site of Photosystem I”. 《Plant Physiology》 172 (1): 450–463. doi:10.1104/pp.16.00647. PMC 5074619. PMID 27406169.
- ↑ 가 나 Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). 〈Photosynthesis, Light, and Life〉. 《Biology of Plants》 7판. New York: W. H. Freeman. 121–127쪽. ISBN 978-0-7167-1007-3.
- ↑ 가 나 Zeiger, Eduardo; Taiz, Lincoln (2006). 〈Ch. 7: Topic 7.8: Photosystem I〉. 《Plant Physiology》 4판. Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7. [깨진 링크(과거 내용 찾기)]
- ↑ 가 나 “The Photosynthetic Process”. 2009년 2월 19일에 원본 문서에서 보존된 문서.
- ↑ 가 나 Shubin VV, Karapetyan NV, Krasnovsky AA (January 1986). “Molecular arrangement of pigment-protein complex of photosystem 1”. 《Photosynthesis Research》 9 (1–2): 3–12. doi:10.1007/BF00029726. PMID 24442279. S2CID 26158482.
- ↑ Rutherford AW, Heathcote P (December 1985). “Primary photochemistry in photosystem-I”. 《Photosynthesis Research》 6 (4): 295–316. doi:10.1007/BF00054105. PMID 24442951. S2CID 21845584.
- ↑ 가 나 다 Grotjohann, I; Fromme, P (2013). 〈Photosystem I〉. 《Encyclopedia of biological chemistry》 Seco판. London. 503–507쪽. doi:10.1016/B978-0-12-378630-2.00287-5. ISBN 978-0-12-378630-2.
- ↑ 가 나 Itoh, Shigeru; Iwaki, Masayo (1989). “Vitamin K1 (Phylloquinone) Restores the Turnover of FeS centers of Ether-extracted Spinach PSI Particles”. 《FEBS Letters》 243 (1): 47–52. doi:10.1016/0014-5793(89)81215-3. S2CID 84602152.
- ↑ Palace GP, Franke JE, Warden JT (May 1987). “Is phylloquinone an obligate electron carrier in photosystem I?”. 《FEBS Letters》 215 (1): 58–62. doi:10.1016/0014-5793(87)80113-8. PMID 3552735. S2CID 42983611.
- ↑ 가 나 다 Vassiliev IR, Antonkine ML, Golbeck JH (October 2001). “Iron-sulfur clusters in type I reaction centers”. 《Biochimica et Biophysica Acta (BBA) - Bioenergetics》 1507 (1–3): 139–60. doi:10.1016/S0005-2728(01)00197-9. PMID 11687212.
- ↑ 가 나 다 라 Forti, Georgio; Maria, Paola; Grubas, Giovanna (1985). “Two Sites of Interaction of Ferredoxin with thylakoids”. 《FEBS Letters》 186 (2): 149–152. doi:10.1016/0014-5793(85)80698-0. S2CID 83495051.
- ↑ 가 나 Madoz J, Fernández Recio J, Gómez Moreno C, Fernández VM (November 1998). “Investigation of the Diaphorase Reaction of Ferredoxin–NADP+
Reductase by Electrochemical Methods” (PDF). 《Bioelectrochemistry and Bioenergetics》 47 (1): 179–183. doi:10.1016/S0302-4598(98)00175-5. - ↑ Hope AB (January 2000). “Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms”. 《Biochimica et Biophysica Acta (BBA) - Bioenergetics》 1456 (1): 5–26. doi:10.1016/S0005-2728(99)00101-2. PMID 10611452.
- ↑ Boudreau E, Takahashi Y, Lemieux C, Turmel M, Rochaix JD (October 1997). “The chloroplast ycf3 and ycf4 open reading frames of Chlamydomonas reinhardtii are required for the accumulation of the photosystem I complex”. 《The EMBO Journal》 16 (20): 6095–104. doi:10.1093/emboj/16.20.6095. PMC 1326293. PMID 9321389.
- ↑ 가 나 다 라 마 Lockau, Wolfgang; Nitschke, Wolfgang (1993). “Photosystem I and its Bacterial Counterparts”. 《Physiologia Plantarum》 88 (2): 372–381. doi:10.1111/j.1399-3054.1993.tb05512.x.