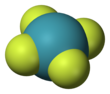
사플루오린화 제논
사플루오린화 제논(Xenon tetrafluoride, 화학식 XeF
4)은 제논 원자와 플루오린 원자가 결합한 화합물이다. 최초로 발견된 비활성 기체의 이진상 화합물이다.[3] 제논과 플루오린 F
2의 화학 반응을 통해 합성시킨다. 화학반응식은 다음과 같다.[4][5]

| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
Xenon tetrafluoride
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.033.858 | ||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| XeF 4 | |||
| 몰 질량 | 207.2836 g mol−1 | ||
| 겉보기 | White solid | ||
| 밀도 | 4.040 g cm−3, solid | ||
| 녹는점 | 117 °C (243 °F; 390 K) sublimes[1] | ||
| Reacts | |||
| 구조 | |||
| D4h | |||
| square planar | |||
| 0 D | |||
| 열화학 | |||
표준 몰 엔트로피 (S
|
146 J·mol−1·K−1[2] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−251 kJ·mol−1[2] | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
- Xe + 2 F
2 → XeF
4
이 과정은 발열 과정이며 제논 원자가 251 kJ/mol의 에너지를 방출한다.[3]
사플루오린화 제논은 상온에서 무색의 결정체 고체 형태이다. 결정 구조는 1963년 핵자기 공명 분광법(NMR 분광법)과 X선 결정학 연구를 통해 밝혀졌다.[6][7] 원자가껍질 전자쌍 반발 이론에 따라 화합물의 분자 구조는 평면 사각형을 이룬다.[8]
합성 편집
사플루오린화 제논은 니켈 용기 안에 제논과 플루오린을 1:5의 비율로 혼합한 기체를 400 °C까지 가열하여 합성한다. 합성 과정에서 육플루오린화 제논 XeF
6도 같이 생성되며 혼합 기체에서 플루오린의 농도가 높아질수록 육플로오린화 제논 화합물의 생성 비율도 같이 높아진다.[9] 합성 반응에서 니켈은 촉매 역할을 하지 않는다. 대신 니켈 용기가 플루오린과 반응하며 표면에 보호막인 플루오린화 니켈(II) NiF
2을 만들기 때문에 주로 니켈로 만든 용기를 사용한다.
화학 반응 편집
사플루오린화 제논은 저온에서 물과 반응에 가수분해되어 원소 제논, 산소, 플루오린화 수소산, 삼산화 제논 등의 화합물을 만든다.[10]
또한 사차암모늄 양이온 플루오린화물과 반응하여 오각형의 음이온기 XeF−
5가 있는 오플루오르제논화 사메틸암모늄을 생성한다. XeF−
5 음이온은 플루오린화 세슘과의 다음 반응에서도 생성된다.[11]
- CsF + XeF
4 → CsXeF
5
오플루오린화 비스무트 (BiF
5)와의 반응에서는 XeF+
3 양이온을 만든다.[12]
- BiF
5 + XeF
4 → XeF3BiF6
XeF+
3 양이온은 XeF3Sb2F11염에서 NMR 분광법을 통해 특정하였다.[13]
400 °C에서 XeF
4는 제논 기체와 반응하여 이플루오린화 제논 XeF
2을 만들어낸다.[9]
- XeF4 + Xe → 2 XeF2
또한 백금과도 반응하여 사플루오린화 백금 PtF
4을 만들고 제논 기체를 방출한다.[9]
- XeF4 + Pt → PtF4 + Xe
각주 편집
- ↑ 가 나 Arnold F. Holleman; Egon Wiberg (2001). Nils Wiberg, 편집. 《Inorganic chemistry》. 번역 Mary Eagleson; William Brewer. Academic Press. 394쪽. ISBN 0-12-352651-5.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles》 6판. Houghton Mifflin Company. A23쪽. ISBN 0-618-94690-X.
- ↑ 가 나 Zumdahl (2007). 《Chemistry》. Boston: Houghton Mifflin. 243쪽. ISBN 0-618-52844-X.
- ↑ Claassen, H. H.; Selig, H.; Malm, J. G. (1962). “Xenon Tetrafluoride”. 《J. Am. Chem. Soc.》 84 (18): 3593. doi:10.1021/ja00877a042.
- ↑ C. L. Chernick; H. H. Claassen; P. R. Fields; H. H. Hyman; J. G. Malm; W. M. Manning; M. S. Matheson; L. A. Quarterman; F. Schreiner; H. H. Selig; I. Sheft; S. Siegel; E. N. Sloth; L. Stein; M. H. Studier; J. L. Weeks & M. H. Zirin (1962). “Fluorine Compounds of Xenon and Radon”. 《Science》 138 (3537): 136–138. Bibcode:1962Sci...138..136C. doi:10.1126/science.138.3537.136. PMID 17818399.
- ↑ Thomas H. Brown; E. B. Whipple & Peter H. Verdier (1963). “Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum”. 《Science》 140 (3563): 178. Bibcode:1963Sci...140..178B. doi:10.1126/science.140.3563.178. PMID 17819836.
- ↑ James A. Ibers & Walter C. Hamilton (1963). “Xenon Tetrafluoride: Crystal Structure”. 《Science》 139 (3550): 106–107. Bibcode:1963Sci...139..106I. doi:10.1126/science.139.3550.106. PMID 17798707.
- ↑ Burns, John H.; Agron, P. A.; Levy, Henri A (1963). “Xenon Tetrafluoride Molecule and Its Thermal Motion: A Neutron Diffraction Study”. 《Science》 139 (3560): 1208–1209. Bibcode:1963Sci...139.1208B. doi:10.1126/science.139.3560.1208. PMID 17757912.
- ↑ 가 나 다 Allen J. Bard; Roger Parsons; Joseph Jordan; International Union of Pure and Applied Chemistry (1985). 《Standard Potentials in Aqueous Solution》. CRC Press. 767–768쪽. ISBN 0-8247-7291-1.
- ↑ Williamson; Koch, C. W. (Mar 1963). “Xenon Tetrafluoride: Reaction with Aqueous Solutions”. 《Science》 139 (3559): 1046–1047. Bibcode:1963Sci...139.1046W. doi:10.1126/science.139.3559.1046. ISSN 0036-8075. PMID 17812981.
- ↑ Charlie Harding; David Arthur Johnson; Rob Janes (2002). 《Elements of the p block (Volume 9 of Molecular world)》. Royal Society of Chemistry. 93쪽. ISBN 0-85404-690-9.
- ↑ Hitomi Suzuki; Yoshihiro Matano (2001). 《Organobismuth chemistry》. Elsevier. 8쪽. ISBN 0-444-20528-4.
- ↑ Gillespie, R. J.; B. Landa; G. J. Schrobilgen (1971). “Trifluoroxenon(IV)µ-fluoro-bispentafluoroantimonate(V): the XeF+
3 cation”. 《Journal of the Chemical Society D: Chemical Communications》 (23): 1543–1544. doi:10.1039/C29710001543.
외부 링크 편집
- xenon tetrafluoride NIST 정보 Archived 2020년 10월 24일 - 웨이백 머신