스타부딘
스타부딘(d4T)는 제리트(Zerit)라는 상품명으로 판매되고 있으며, 후천면역결핍증후군(HIV/AIDS)을 예방 및 치료하는데 사용되는 고정 용량의 항레트로바이러스 복합제제이다.[3] 이 약물은 다른 항레트로바이러스제와 함께 사용하도록 권고되고 있다.[3] 주사기와 같은 날카로운 바늘에 찔리거나 이외의 잠재적으로 바이러스에 노출된 것으로 보일 때 예방 차원에서 사용될 수 있다. 하지만 이 약물은 1차 치료제로 사용되지 않으며[3] 경구로 복용한다.[3]
| |
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
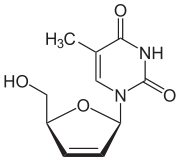
| 1-[(2R,5S)-5-(hydroxymethyl)-2,5-dihydrofuran-2-yl]-5-methyl-1,2,3,4-tetrahydropyrimidine-2,4-dione | |
| 식별 정보 | |
| CAS 등록번호 | 3056-17-5 |
| ATC 코드 | J05AF04 |
| PubChem | 18283 |
| 드러그뱅크 | DB00649 |
| ChemSpider | 17270 |
| 화학적 성질 | |
| 화학식 | C10H12N2O4 |
| 분자량 | ? |
| 유의어 | 2′,3′-didehydro-2′,3′-dideoxythymidine |
| 약동학 정보 | |
| 생체적합성 | >80% |
| 단백질 결합 | Negligible |
| 동등생물의약품 | ? |
| 약물 대사 | Kidney elimination (~40%) |
| 생물학적 반감기 | 0.8–1.5 hours (in adults) |
| 배출 | ? |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) C(미국) |
| 법적 상태 | |
| 투여 방법 | By mouth |
흔한 부작용으로는 두통, 설사, 구토, 발진과 말초신경장애가 있다.[3] 심각한 이상반응으로는 고젖산혈증, 췌장염과 비대해진 간이 있다.[3] 임신 중의 사용은 권장되지 않는다.[3] 스타부딘은 뉴클레오시드 유사체 역전사효소 억제제(NRTI) 계열의 약물이다.[3]
스타부딘은 1966년 처음 등장했으며, 1994년 미국에서 사용 승인을 받았다.[4] 제네릭 의약품으로 판매되고 있다.[3]
의학적 사용/용도 편집
스타부딘은 HIV-1 감염 시 사용하는 약물이지만, 증상 및 상태가 호전될 뿐 완치를 해주지는 못한다. 그 결과 일반적으로 일차 치료제로 권장되지 않는다.[5] 스타부딘은 업무 중(ex. 주사바늘) 혹은 감염된 혈액이나 체액의 접촉을 통해 바이러스에 노출되었을 때 HIV-1 감염으로의 발전 가능성을 줄일 수 있다.[6] 스타부딘은 HIV 감염 시의 상태를 조절하고, 합병증으로의 진행을 줄이기 위해 다른 HIV 치료제와 병용하는 방식으로 사용된다.[7]
세계보건기구(WHO)는 스타부딘의 독성이 매우 심각하다는 점을 고려해 시장에서 이 약물의 퇴출을 주장하고 있다. 그럼에도 불구하고 약물의 사용이 불가피하다면, 부작용의 빈도를 줄이기 위해 저용량을 사용하도록 권장하고 있다. 하지만 2015년 Cochrane review에서 관찰한 결과 고용량 용법과 저용량 용법 사이에 특별한 차이점을 찾지 못했다.[8]
임신과 수유 편집
스타부딘은 동물 실험을 진행한 결과 태아에게 영향을 미친다는 사실이 밝혀졌으나 사람을 대상으로 한 임상실험에서는 이와 관련된 데이터가 밝혀지지 않았다.[9] 그렇기 때문에 임산부의 경우 태아에게 미칠 잠재적인 문제점보다 이 약물을 사용했을 때 얻을 수 있는 장점이 더 큰 경우 스타부딘을 사용하는 것이 좋다. 추가적인 연구로 스타부딘과 디다노신 그리고 다른 항바이러스제를 같이 병용한 경우 임산부에서 치명적인 젖산 산증을 보임이 밝혀진 바 있다.[9]
소아 편집
태아가 태어난 시기부터 청소년기에 해당하는 연령대까지의 소아 및 청소년에서 스타부딘의 사용은 안전하다. 약물 사용 시의 이상반응과 안전에 관한 사항은 성인에서와 동일하다.[1]
노인 편집
HIV에 감염된 65세 이상 성인(노인)에서의 스타부딘 사용에 대한 데이터가 없다. 하지만 65세 이상의 환자 12000명 중 30%에 해당하는 환자가 이 약물을 복용했을 때 말초신경병증을 경험하였다.[1] 또한 노인의 경우 대부분 신장의 기능이 떨어져 있는 경향을 보이기 때문에 독성에 더 취약하고 심각한 부작용이 발생할 가능성이 매우 높다.[10]
이상반응 편집
흔한 부작용[1]
- 구역
- 구토
- 설사
- 두통
- 위장관 불편함
심각한 부작용/이상반응[1]
- 말초신경병증
- 젖산산증
- 췌장염
- 간독성
- 간섬유화를 동반한 간비대
- 지방위축증/지질영양이상증 (지방 재분포/축적)
위 약물을 복용하는 경우 이러한 심각한 이상반응이 일어나는지에 대한 모니터링이 실시된다. 말초신경병증의 증상발현은 용량과 밀접한 관계를 보이는 것으로 추정되며, 이러한 이상반응은 약물 복용 중단 시 해소될 수 있다. 중증의 HIV-1 환자이거나 말초신경병증을 앓은 경험이 있는 경우, 또는 다른 약물을 복용했을 때에 신경과 관련된 이상반응을 경험했던 환자들에게서 이러한 부작용이 더 빈번하게 나타났다.[1]
스타부딘은 실험실 시험 결과 유전 독성을 나타내는 것으로 보여졌으나 임상에서 사용되는 용량을 사용했을 때 암을 유발하는 효과를 발견할 수 없었다. 고젖산혈증, 골밀도저하(BMD), 사지(팔, 다리)의 지방 감소 그리고 중성지방의 증가는 고용량으로 복용했을 때 나타났다. 이 약물은 항바이러스제 중 지질영양이상증을 유발할 수 있는 위험성이 큰 약물이며, 이러한 이유로 현재 개발국에서는 스타부딘을 환자들에게 적절한 치료약물로 고려하지 않는다.
태국에서 진행된 연구에 따르면 HLA-B*4001의 유무가 스타부딘을 복용했을 때 지방영양이상증이 나타날지를 예측하게 해주는 유전적 마커이며, 이것이 스타부딘의 복용을 피하거나 스타부딘의 노출시간을 줄이는 기준이 된다.[11]
인도와 같은 자원이 넉넉하지 않은 환경에서는 스타부딘이 여전히 1차 약제로 사용되고 있다. 말초신경병증이 발병하거나 임산부인 경우에만 2차 선택약물인 지도부딘이 사용된다. 한번도 치료를 받아보지 않은 환자에게 안전성과 효능이 보장되는 용량적정에 대해서는 밝혀진 바가 없다. 지속바이러스반응(SVR; sustained virologic response)을 보이는 환자에 대해서만 밝혀진 바 있다.
2009년 11월 30일 월요일에 세계보건기구는 "장기간동안 지속되고 회복이 되지 않는 부작용 혹은 이상반응 때문에 스타부딘 혹은 d4T에 대한 사용을 중단할 것을 권장한다. 쉽게 구할 수 있고 약가(비용)가 적다는 점에서 개발도상국에서는 여전히 스타부딘이 1차 약제로 널리 쓰이고 있다. 독성이 덜하고 똑같은 효능을 지닌 대체제로써 지도부딘(AZT) 또는 테노포비르(TDF)을 권장한다" 라고 공고하였다.[12]
작용 메커니즘 편집
스타부딘은 티미딘의 뉴클레오사이드 유사체로, 세포 내에 존재하는 키나아제에 의해서 인산화되어 활성형의 스타부딘 삼인산이 된다. 스타부딘 삼인산은 자연적 기질인 티미딘 삼인산과 경쟁하여 HIV의 역전사효소에 결합해 그 기능을 저해한다. 역전사효소는 바이러스가 자신의 유전물질을 숙주의 DNA에 삽입하기 위해 사용하는 효소로, 바이러스의 유전물질인 RNA를 DNA 형태로 복사해준다. 스타부딘 삼인산이 티미딘 삼인산 대신 DNA 가닥에 삽입되면서 DNA 복제과정을 중단시킨다.
약동학적 특성 편집
흡수: 스타부딘은 빠른 흡수율과 좋은 생체이용률을 보인다.(F=0.86)[13]
분포: 스타부딘은 혈장에 존재하는 단백질에 결합하지 않는다.[13]
대사: 스타부딘의 소실과정은 간 대사에 영향을 거의 받지 않는다. 산화와 글루쿠론산 과정은 소량의 대사체를 형성한다.[13]
배설: 스타부딘은 대부분 변형없이 그대로 소변으로 배출된다.[13]
약물 상호작용 편집
지도부딘과 같이 복용하면 세포 내에서 스타부딘의 인산화 과정을 저해할 수 있어 병용 사용은 권장되지 않는다. 다른 항 HIV 약물들은 이러한 작용을 보이지 않는다.
스타부딘은 혈장단백질과 결합하거나 주된 사이토크롬 P450 이성체의 기능을 억제하지 않는다. 그러므로 사이토크롬 P450을 통해서 대사되거나 혈장단백질과 결합하는 약물들과는 특별히 큰 상호작용을 보이지 않는다.[13]
역사 편집
스타부딘은 제롬 호르비츠(Jerome Horwitz)에 의해 1960년대에 처음 개발되었으며, 'd4T'라는 이름으로 출시되었다.[14] 에이즈가 급속하게 유행하기 시작했던 1980년대에 윌리엄 플스오프(William Prusoff)와 의사 타이-션 린(Tai-Shun Lin)은 스타부딘의 항 HIV 효과를 발견했다.[13] 제약회사 브리스톨-마이어스 스큅은 이 약물을 '제리트'라는 상호명으로 제조하고 있다.[13]
스타부딘은 개발 중인 신약에 대해 승인을 받기 전부터 환자들이 원한다면 사용이 가능하도록 허용한 최초의 약물로, 1992년 미국 식품의약국(FDA)에서 'parrallel track'로 허가해주었다. 스타부딘은 FDA의 가속 승인 절차 과정을 통해 서류 제출이 이루어졌고, 이로 인해 임상이 끝난 시점에서의 결과가 아닌 CD4라는 마커로 대신하여 약물의 효능을 측정하였다. FDA는 CD4 세포 수의 증가가 얼마나 에이즈와 HIV 감염에 효과적인 약물인지를 보여준다고 판단하였다. 스타부딘은 1994년 6월 27일에 에이즈와 HIV 감염에 대한 4번째 치료제로 FDA의 허가받았다. 승인을 받았음에도 불구하고, 스타부딘은 약물의 임상적인 효과를 평가하기 위한 연구들이 지속되었다. 만약 임상에서 약물이 특별히 효능을 보이지 못한다면, 가속 승인은 철회될 수 있다.[15]
2018년 마일란 제약회사는 스타부딘 20mg, 30mg과 40mg 캡슐 제조를 중단하였다.[16]
각주 편집
- ↑ 가 나 다 라 마 바 “Stavudine capsule”. 《DailyMed》. 2019년 9월 21일. 2020년 10월 13일에 확인함.
- ↑ “Zerit EPAR”. 《European Medicines Agency (EMA)》. 2020년 10월 13일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 “Stavudine Monograph for Professionals - Drugs.com”. 《www.drugs.com》. 2016년 11월 10일에 원본 문서에서 보존된 문서. 2016년 11월 9일에 확인함.
- ↑ “New HIV recommendations to improve health, reduce infections and save lives”. 세계보건기구. 2009년 11월 30일. 2010년 1월 18일에 원본 문서에서 보존된 문서.
- ↑ “Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV—United States, 2016” (PDF). 《Center for Disease Control and Prevention》. Annals of Emergency Medicine. 2016년 11월 20일에 원본 문서 (PDF)에서 보존된 문서. 2016년 8월 11일에 확인함.
- ↑ “Jerome Horwitz”. 《Telegraph.co.uk》. 2016년 11월 7일에 원본 문서에서 보존된 문서. 2016년 11월 6일에 확인함.
- ↑ Bristol-Myers Squibb (December 2012). “Zerit (stavudine) capsules and powder for oral solution prescribing information” (PDF). Princeton, NJ. 2017년 1월 31일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Magula, N; Dedicoat, M (2015년 1월 28일). “Low dose versus high dose stavudine for treating people with HIV infection.”. 《The Cochrane Database of Systematic Reviews》 1: CD007497. doi:10.1002/14651858.CD007497.pub2. PMID 25627012.
- ↑ 가 나 “Stavudine capsule”. 《DailyMed》. 2019년 9월 21일. 2020년 10월 13일에 확인함.
- ↑ “FDA Guideline for Industry: Geriatric Population” (PDF). 《FDA.gov》. 2016년 9월 14일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Wangsomboonsiri W, Mahasirimongkol S, Chantarangsu S, 외. (2010년 2월 15일). “Association between HLA-B*4001 and lipodystrophy among HIV-infected patients from Thailand who received a stavudine-containing antiretroviral regimen”. 《Clinical Infectious Diseases》 50 (4): 597–604. doi:10.1086/650003. PMID 20073992.
- ↑ “New HIV recommendations to improve health, reduce infections and save lives”. 세계보건기구. 2009년 11월 30일. 2010년 1월 18일에 원본 문서에서 보존된 문서.
- ↑ 가 나 다 라 마 바 사 Bristol-Myers Squibb (December 2012). “Zerit (stavudine) capsules and powder for oral solution prescribing information” (PDF). Princeton, NJ. 2017년 1월 31일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ “Jerome Horwitz”. 《Telegraph.co.uk》. 2016년 11월 7일에 원본 문서에서 보존된 문서. 2016년 11월 6일에 확인함.
- ↑ “FDA Approval of Stavudine (d4T) | News | AIDSinfo”. 《AIDSinfo》. 2016년 11월 7일에 원본 문서에서 보존된 문서. 2016년 11월 6일에 확인함.
- ↑ U.S. Food and Drug Administration 10903 New Hampshire Avenue Silver Spring, MD 20993 1-888-INFO-FDA (1-888-463-6332). (2018, April 30). FDA Drug Shortages. Retrieved May 1, 2018, from https://www.accessdata.fda.gov/scripts/drugshortages/dsp_ActiveIngredientDetails.cfm Drug Shortages&AI=Stavudine Capsules&st=d&tab=tabs-4&panels=0&elqTrackId=ea74e0ed22944bcb80c0e85a7812de68&elq=eba2efb7014449bd94d27eba432bc417&elqaid=3343&elqat=1&elqCampaignId=2529#
외부 링크 편집
- “Stavudine”. 《Drug Information Portal》. U.S. National Library of Medicine.