리토나비르
리토나비르(Ritonavir, RTV)는 노르비르(Norvir)라는 이름으로 판매되며, 후천면역결핍증후군을 치료하기 위해 다른 약물과 함께 사용되는 항레트로바이러스제이다. 이런 다양한 약물을 병용하는 결합 치료법은 강력 항레트로바이러스요법(HAART)으로도 알려져 있다. 주로 다른 프로테아제 억제제와 함께 낮은 복용량으로 사용되며, 다른 약물들과 함께 C형 간염 치료를 위해 사용될 수 있다. 경구투여하며, 캡슐보다 알약(tablet)형이 더 높은 효율을 보여준다.[1]
| |

| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
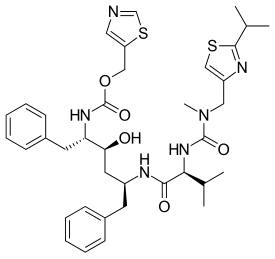
| 1,3-thiazol-5-ylmethyl N-[(2S,3S,5S)-3-hydroxy-5-[(2S)-3-methyl-2-{[methyl({[2-(propan-2-yl)-1,3-thiazol-4-yl]methyl})carbamoyl]amino}butanamido]-1,6-diphenylhexan-2-yl]carbamate | |
| 식별 정보 | |
| CAS 등록번호 | 155213-67-5 |
| ATC 코드 | J05AE03 |
| PubChem | 392622 |
| 드러그뱅크 | DB00503 |
| ChemSpider | 347980 |
| 화학적 성질 | |
| 화학식 | C37H48N6O5S2 |
| 분자량 | 720.946 g/mol |
| SMILES | eMolecules & PubChem |
| 약동학 정보 | |
| 생체적합성 | ? |
| 단백질 결합 | 98-99% |
| 동등생물의약품 | ? |
| 약물 대사 | 간 |
| 생물학적 반감기 | 3-5시간 |
| 배출 | 대부분 대변 |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) B(미국) |
| 법적 상태 | |
| 투여 방법 | 경구 투여 |
일반적인 부작용으로는 메스꺼움, 구토, 식욕부진, 설사, 손발 마비 등이 있다. 심각한 부작용으로는 간 질환, 췌장염, 알레르기 반응, 부정맥 등이 있다. 이러한 심각한 부작용은 아미오다론이나 심바스타틴 등 다른 약물들에서도 나타난다.[1] 적은 복용량에 한정하여 임신 중에도 사용할 수 있는 것으로 보인다.[2] 프로테아제 억제제 등급인데,[1] 일반적으로 다른 프로테아제 억제제 분해효소를 억제하는 용도로 사용된다. 따라서 다른 다른 프로테아제 억제제를 리토나비르와 함께 투여할 경우 적은 양만 투여해도 높은 효과를 볼 수 있다.[3]
리토나비르는 1989년에 특허를 받았고 1996년에 의학적으로 사용되기 시작했다.[4][5] 현재 가장 안전하고 효과적인 의약품으로 의료제도에서 필수적인 의약품 목록인 WHO 필수 의약품 목록에 등재되어 있다.[6] 개발도상국에서의 도매가는 보통 하루에 0.07달러에서 2.20달러 사이로 책정된다.[7] 미국에서는 복용량에 따라 하루에 약 9.20–55달러가 든다.[1]
작용 기작
리토나비르는 원래 유사-C2-대칭 소형분자 억제자 계열 중 하나로, HIV 프로테아제 억제제로 개발되었다. 현재는 본연의 항바이러스적 목적으로 사용되는 경우는 드물고, 보통 다른 프로테아제 억제제의 보조제로 사용한다. 좀더 구체적으로 말하자면, 리토나비르는 간이나 췌장 등에서 발견되는 프로테아제 억제제를 대사하는 효소인 CYP3A4를 억제하기 위해 사용된다.[8] 따라서 낮은 복용량을 다른 단백질 분해효소 억제제와 함께 투여하여 다른 약물을 강화할 수 있다. 이 발견을 통해 부작용이 획기적으로 감소하였으며, 프로테아제 억제제 및 HAART의 효능이 향상되었다. 그러나 CYP3A4의 정상적인 기능 때문에 리토나비르는 다른 정상적인 약물의 효능에도 영향을 끼친다. 따라서 여러 약을 동시에 약을 처방하는 경우 어려움을 가중시킨다.[9]
약물동력학 및 약력학
캡슐은 일반 알약 형태와 비교했을 때 효과가 떨어진다.[1]
역사
리토나비르는 애브비(AbbVie) 주식회사에서 노르비르라는 제품명으로 제조된다. 미국 식품의약국(FDA)에서 1996년 3월 1일 리토나비르를 승인함에 따라 미국에서 승인된 7번째 항레트로바이러스제이자, 4번째 프로테아제 억제제가 되었다. 프로테아제 억제제인 리토나비르와 사퀴나비르를 승인함으로써 강력 항레트로바이러스요법(HAART)을 도입한 결과, 미국의 HIV 연관 사망률은 2년간 5만 명 이상에서 약 1만 8천 명으로 떨어졌다.[11][12]
2003년에는 애봇사(현재의 애브비사)가 노르비르의 가격을 1.71달러에서 8.57달러로 인상함에 따라, 환자 및 의회로부터 비난을 받는다. 이에 따라 소비자그룹은 국립보건원(NIH)에게 노르비르 특허 승인을 번복할 것을 청원하였으나, 2004년 8월 4일 NIH는 그럴 권리가 없다며 이를 거부한다.[13] 2014년 FDA는 옴비스타비르, 파리타프레비르와 함께 묶어서 C형 간염 바이러스 유전자형 4의 치료제로 옴비스타비르/파리타프레비르/리토나비르를 허용한다.[14]
각주
- ↑ 가 나 다 라 마 “Ritonavir”. The American Society of Health-System Pharmacists. 2015년 10월 17일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ “Ritonavir Pregnancy and Breastfeeding Warnings”. 《drugs.com》. 2015년 9월 7일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ 《British National Formulary 69》 69판. Pharmaceutical Pr. 2015년 3월 31일. 426쪽. ISBN 9780857111562.
- ↑ Hacker, Miles (2009). 《Pharmacology principles and practice》. Amsterdam: Academic Press/Elsevier. 550쪽. ISBN 9780080919225.
- ↑ Fischer, Jnos; Ganellin, C. Robin (2006). 《Analogue-based Drug Discovery》 (영어). John Wiley & Sons. 509쪽. ISBN 9783527607495.
- ↑ World Health Organization (2019). 《World Health Organization model list of essential medicines: 21st list 2019》. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ “Ritonavir”. 《International Drug Price Indicator Guide》. 2017년 5월 10일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ Zeldin RK, Petruschke RA (2004). “Pharmacological and therapeutic properties of ritonavir-boosted protease inhibitor therapy in HIV-infected patients”. 《Journal of Antimicrobial Chemotherapy》 53 (1): 4–9. doi:10.1093/jac/dkh029. PMID 14657084. 2007년 8월 21일에 원본 문서에서 보존된 문서.
- ↑ Research, Center for Drug Evaluation and (2019년 12월 3일). “Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers”. 《FDA》 – www.fda.gov 경유.
- ↑ “Wayback Machine” (PDF). 2015년 9월 24일에 원본 문서 (PDF)에서 보존된 문서. 2020년 2월 17일에 확인함.
- ↑ “HIV Surveillance—United States, 1981-2008”. 2013년 11월 9일에 원본 문서에서 보존된 문서. 2013년 11월 8일에 확인함.
- ↑ The CDC, in its Morbidity and Mortality Weekly Report, ascribes this to "highly active antiretroviral therapy", without mention of either of these drugs, see the preceding citation. A further citation is needed to make this accurate connection between this drop and the introduction of the protease inhibitors.
- ↑ Ceci Connolly (2004년 8월 5일). “NIH Declines to Enter AIDS Drug Price Battle”. 《Washington Post》. 2008년 8월 20일에 원본 문서에서 보존된 문서. 2006년 1월 16일에 확인함.
- ↑ “FDA approves Viekira Pak to treat hepatitis C”. Food and Drug Administration. 2014년 12월 19일. 2015년 10월 31일에 원본 문서에서 보존된 문서.
참고 문헌
- Chemburkar, Sanjay R.; Bauer, John; Deming, Kris; Spiwek, Harry; Patel, Ketan; Morris, John; Henry, Rodger; Spanton, Stephen; 외. (2000). “Dealing with the Impact of Ritonavir Polymorphs on the Late Stages of Bulk Drug Process Development”. 《Organic Process Research & Development》 4 (5): 413–417. doi:10.1021/op000023y.
외부 링크
- PubPK - Ritonavir pharmacokinetics
- [1] (manufacturer's website)
- Ritonavir bound to proteins in the PDB
- Norvir Prescribing Information