면역요법
면역요법(免疫療法, 영어: Immunotherapy)은 기본적으로 면역학적 방법으로 환자 치료를 기획하는 것을 말한다.
| 면역요법 | |
|---|---|
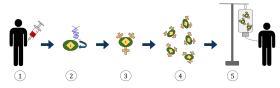 위 그림은 면역요법 중 하나이며 암 치료에 점점 더 사용되고 있는 키메라 항원 수용체 T 세포 (CAR) 치료를 나타낸 것이다. 마지막에는 체내의 감염된 암세포를 인식하고 싸우는 능력을 갖춘 T 세포가 된다.
| |
| MeSH | D007167 |
| OPS-301 코드 | 8-03 |
면역요법은 크게 특정 항원에 대한 면역 반응에만 관여하는 특이적 면역요법(activation immunotherapies)과 전체 면역계에 관여하는 비특이적 면역요법(suppression immunotherapies)이 있다. 감염이 원인일 경우에는 병원체나 감염원의 독소에 대한 면역체를 체내에 이입하거나, 인공적으로 면역체를 생산 또는 증강시켜 치료에 도움을 준다.
면역 요법이 다양한 암을 치료할 수 있다는 점에서 연구원, 임상 및 제약회사가 높은 관심을 보이고 있다.[1][2][3] 이에 따라 환자 치료가 더 복잡해질 뿐 아니라 암 치료의 기준도 바뀌고 있다.[4][5][6][7][8][9]
면역 조절(immunomodulatory) 약물은 현재 신체에 미치는 영향이 알려지지 않았다.[10]
세포 기반 면역요법은 일부 암에 효과적이다. 림프구, 대식세포, 수지상세포, 자연살해세포 (NK Cell), 세포독성 T세포 (CTL) 같은 면역 효과기 세포가 함께 작용하여 종양 세포 표면에 발현된 비정상 항원을 표적으로 삼아 암으로부터 신체를 방어한다.
면역요법 중 과립구 집락 자극 인자 (G-CSF), 인터페론, 이미퀴모드 및 세균의 세포막 분획과 같은 치료법은 이미 의료용으로 허가되었다. IL-2, IL-7, IL-12, 다양한 케모카인, 합성 시토신 인산-구아노신(CpG) 올리고데옥시뉴클레오타이드 및 글루칸을 포함한 기타 물질은 임상 및 전임상 연구 진행 중에 있다.
면역 조절제 편집
면역 조절제는 면역 요법의 활성제로 다양한 재조합, 합성 및 천연 제제이다.[11]
| 종류 | 예시 물질 |
|---|---|
| 인터루킨 (Interleukins) | IL-2, IL-7, IL-12 |
| 사이토카인 (Cytokines) | 인터페론, G-CSF |
| 케모카인 (Chemokines) | CCL3, CCL26, CXCL7 |
| 면역조절 이미드 물질 (IMiDs) | 탈리도마이드 및 그 유사체(레날리도마이드, 포말리도마이드, 아프레밀라스트 등), BCG 백신,[12][13] 코로나바이러스 백신[14][15][16] |
| 그 외 | 시토신 포스페이트-구아노신, 올리고데옥시뉴클레오티드, 글루칸 |
활성화 면역요법 편집
암 편집
기존의 암 치료는 화학 요법이나 수술 또는 방사선으로 암세포와 종양을 죽이거나 제거하는 데 중점을 두었다. 이러한 치료법은 매우 효과적일 수 있으며 많은 경우에 여전히 사용되고 있다.
면역 요법은 국소 및 전신 모두에서 면역 반응을 유도하며 암 면역 요법은 면역 체계를 자극하여 종양을 파괴하는 원리를 기반으로 한다. 그러기 위한 다양한 방법이 사용 중이거나 연구 및 테스트 중이다. 다양한 암에 대한 무작위 대조 연구에서 생존 및 무병 기간의 유의한 증가가 보고되었고 세포기반 면역치료와 기존 치료법을 병행할 경우 약 20~30%의 상승 된 효과를 보이는 것으로 나타났다.
가장 오래된 형태의 암 면역 요법 중 하나는 BCG 백신을 사용하는 것이다. BCG 백신은 원래 결핵 예방 접종을 목적으로 했으나 나중에 방광암 치료에 유용한 것으로 밝혀졌다. BCG 면역 요법이 종양 면역을 매개하는 기전은 널리 연구되어 왔지만 아직 완전히 파악되지는 않았다.
암 치료에서 단클론 항체의 사용은 B 세포 림프종의 치료를 위한 항-CD20 항체인 리툭시맙과 함께 1997년에 처음 도입되었다. 그 이후로 여러 가지 단클론 항체가 다양한 혈액 악성 종양과 고형 종양 치료에 승인되었다.
혈액에서 G-CSF 림프구를 추출하고 적절한 자극 사이토카인으로 세포를 재주입하기 전에 종양 항원에 대해 시험관 내에서 확장한다. 그런 다음 세포는 항원을 발현하는 종양 세포를 파괴한다. 국소 면역 요법은 인터페론을 생성 하는 면역 강화 크림(이미퀴모드)을 사용하여 수용자의 세포독성 T세포가 사마귀를 파괴하도록 한다. 광선각화증, 기저 세포암, 질 상피내 종양, 편평 세포암, 피부 림프종 및 표재성 악성 흑색종. 주사 면역요법(병소내 또는 종양내)은 볼거리, 칸디다, HPV 백신, 트리코피틴 항원 주사를 사용하여 사마귀(HPV 유도 종양)를 치료한다.
입양 세포 이식은 폐암 및 기타 암에 대해 테스트되었으며 흑색종에서 가장 큰 성공을 거두었다.
각주 편집
- ↑ “Immunotherapy - Memorial Sloan Kettering Cancer Center”. 《mskcc.org》. 2017년 7월 27일에 확인함.
- ↑ Syn NL, Teng MW, Mok TS, Soo RA (December 2017). “De-novo and acquired resistance to immune checkpoint targeting”. 《The Lancet. Oncology》 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ↑ Conforti L (February 2012). “The ion channel network in T lymphocytes, a target for immunotherapy”. 《Clinical Immunology》 142 (2): 105–106. doi:10.1016/j.clim.2011.11.009. PMID 22189042.
- ↑ Wang, S., Zimmermann, S., Parikh, K., Mansfield, A.S., &Adjei, A.A. (2019). Current diagnosis and management of small-cell lung cancer. Mayo Clinic Proceedings, 94(8), 1599–1622. https://doi.org/10.1016/j.mayocp.2019.01.034
- ↑ Prettyman, J., Engel, L., Boldt-Houle, D.M., Atkinson, S., & Wilt, W. (2018). Personalizing treatment in the delivery of care by nurses to patients with prostate cancer. Urologic Nursing, 39(2), 83–99. https://doi.org/10.7257/1053-816x .2019.39.2.83
- ↑ Clarke, J.M., George, D.J., Lisi, S., & Salama, A.K.S. (2018). Immune checkpoint blockade: The new frontier in cancer treatment. Targeted Oncology, 13(1), 1–20. https://doi.org/ 10.1007/s11523-017-0549-7
- ↑ Chalmers, A.W., Patel, S.B., & Akerley, W. (2018). Immunother-apy after chemoradiotherapy in stage III non-small cell lung cancer: A new standard of care? Journal of Thoracic Disease, 10(3), 1198–1200. https://doi.org/10.21037/jtd.2018.01.160
- ↑ Bayer, V., Amaya, B., Baniewicz, D., Callahan, C., Marsh, L., & McCoy, A. S. (2017). Cancer immunotherapy: An evidence-based overview and implications for practice. Clinical Journal of Oncology Nursing, 21(2, Suppl.), 13–21. https://doi.org/10.1188/17.CJON.S2.13-211
- ↑ Offner B.J., Rinke L. Immunotherapy assessment: Using a survey instrument to examine oncology nurses' confidence levels with administration and management. Clin. J. Oncol. Nurs.. 2021;25(3):343-346. doi:10.1188/21.CJON.343-346
- ↑ Bascones-Martinez A, Mattila R, Gomez-Font R, Meurman JH (January 2014). “Immunomodulatory drugs: oral and systemic adverse effects”. 《Medicina Oral, Patologia Oral y Cirugia Bucal》 19 (1): e24–e31. doi:10.4317/medoral.19087. PMC 3909428. PMID 23986016.
- ↑ Rizk JG, Kalantar-Zadeh K, Mehra MR, Lavie CJ, Rizk Y, Forthal DN (September 2020). “Pharmaco-Immunomodulatory Therapy in COVID-19”. 《Drugs》 80 (13): 1267–1292. doi:10.1007/s40265-020-01367-z. PMC 7372203. PMID 32696108.
- ↑ “Immunomodulators and Their Side Effects”. 《www.cancer.org》. 2021년 6월 6일에 확인함.
- ↑ Martino A, Casetti R, Poccia F (January 2007). “Enhancement of BCG-induced Th1 immune response through Vgamma9Vdelta2 T cell activation with non-peptidic drugs”. 《Vaccine》 25 (6): 1023–1029. doi:10.1016/j.vaccine.2006.09.070. PMID 17118497.
- ↑ Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, 외. (October 2020). “COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses”. 《Nature》 586 (7830): 594–599. Bibcode:2020Natur.586..594S. doi:10.1038/s41586-020-2814-7. PMID 32998157.
- ↑ Woldemeskel BA, Garliss CC, Blankson JN (May 2021). “SARS-CoV-2 mRNA vaccines induce broad CD4+ T cell responses that recognize SARS-CoV-2 variants and HCoV-NL63”. 《The Journal of Clinical Investigation》 131 (10). doi:10.1172/JCI149335. PMC 8121504. PMID 33822770.
- ↑ Geers D, Shamier MC, Bogers S, den Hartog G, Gommers L, Nieuwkoop NN, 외. (May 2021). “SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees”. 《Science Immunology》 6 (59): eabj1750. doi:10.1126/sciimmunol.abj1750. PMID 34035118.