세포대사
세포대사(細胞代謝, 영어: cell metabolism)는 유기체를 이루고 있는 세포가 영양소 분자를 처리해서 살아있는 상태를 유지하는 과정이다. 세포대사의 세 가지 주요 목적은 다음과 같다. (1) 세포 내에서 일어나는 일련의 과정들의 진행을 위해 음식을 에너지로 전환시킴. (2) 단백질, 지질, 핵산, 그리고 일부 탄수화물을 만들기 위한 재료로서 음식을 분해시킴. (3) 질소성 폐기물의 제거. 이러한 효소에 의해 촉매되는 반응들은 유기체가 성장과 번식을 하고, 구조를 유지하며 환경에 반응할 수 있게 해준다.
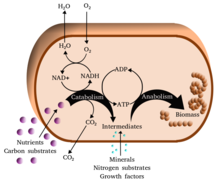
또한 세포대사는 크게 두가지로 구분된다. 하나는 이화작용으로 에너지를 얻기 위해 복잡한 분자를 분해하는 과정이며, 또 다른 하나는 동화작용으로 에너지를 소비해서 보다 복잡한 분자를 합성하며 세포 구조를 형성하는 등의 생명 활동을 하는 것이다.
세포대사는 대사경로라고 불리는 매우 복잡한 일련의 화학반응으로 구성되어 있다. 한 화학 물질은 일련의 단계를 통해 다른 화학 물질로 변형되며, 각 단계는 특정 효소에 의해 촉진된다. 효소는 유기체가 에너지를 방출하는 자발적인 반응에 참여함으로써 스스로는 발생하지 않는 에너지를 필요로하는 반응을 유도해낼 수 있기 때문에 대사 과정에 필수적이다.
특정 유기체의 대사 체계는 어떤 물질이 영양가 있고 어떤 독성이 있는지를 결정한다. 예를 들어 일부 원핵생물은 황화수소를 영양소로 사용하지만 이 가스는 동물에게 유독하다. 유기체의 기본 대사율은 이러한 모든 화학 반응에 의해 소비되는 에너지의 양을 측정한 것이다.
이화작용 편집
이화작용은 큰 분자를 분해하는 대사 과정의 집합이다. 이것들은 음식 분자를 분해하고 산화시키는 것을 포함한다. 분자 반응의 목적은 분자를 형성하는 아나볼릭 반응에 필요한 에너지와 성분을 제공하는 것이다. 이러한 격변기 반응의 정확한 성질은 유기체마다 다르며, 유기체는 아래 표와 같이 에너지와 탄소(그들의 1차 영양군)의 원천을 기준으로 분류할 수 있다. 유기 분자는 유기체들에 의해 에너지의 원천으로 이용되고, 반면 석회질은 무기 기판을 사용하며, 광자체는 화학 에너지로 햇빛을 포착한다. 그러나, 이 모든 다른 형태의 신진대사는 유기 분자, 물, 암모니아, 황화수소 또는 철 이온과 같은 감소된 공여 분자에서 산소, 질산 또는 황산염과 같은 수용 분자로 전자가 전달되는 것을 수반하는 리독스 반응에 의존한다.[1] 동물에서 이러한 반응은 이산화탄소나 물과 같은 단순한 분자로 분해되는 복잡한 유기 분자를 포함한다. 식물이나 시아노박테리아와 같은 광합성 유기체에서 이러한 전자전달 반응은 에너지를 방출하는 것이 아니라 햇빛으로부터 흡수된 에너지를 저장하는 방법으로 사용된다.[2]
동물에서 가장 흔한 격변기 반응은 크게 세 단계로 나눌 수 있다. 첫 번째 단계에서는 단백질, 다당류 또는 지질 같은 큰 유기 분자가 세포 밖의 작은 성분으로 소화된다. 다음으로, 이 작은 분자들은 세포에 의해 흡수되어 작은 분자로 변환되는데, 보통 아세틸 코엔자임 A(acetyl-CoA)는 에너지를 방출한다. 마지막으로, CoA의 아세틸 그룹은 구연산 사이클과 전자 운송 체인의 물과 이산화탄소로 산화되어 코엔자임 니코틴아미드 아데닌 디뉴클레오티드(NAD+)를 NADH로 감소시켜 저장되는 에너지를 방출한다.
분해 편집
분해는 에너지를 생성하기 위해 고분자를 쪼개는 대사 과정이다. 녹말, 셀룰로스, 단백질 등의 고분자는 세포 내로 빠르게 흡수될 수 없고, 세포 대사에 이용되기 전에 더 작은 단위로 분해되어야 한다. 일반적인 효소 몇몇이 이러한 중합체를 소화한다. 소화 효소에는 단백질을 아미노산으로 분해하는 단백질 가수분해 효소, 다당류를 단당류 같은 단순한 당으로 분해하는 글리코사이드 가수분해효소(글리코시데이스) 등이 있다. 미생물은 단순히 주변에 소화 효소를 분비하고,[3][4] 동물만이 특수한 세포에서 장으로 효소를 분비한다.[5] 세포 바깥에서 효소가 고분자를 분해하여 만들어낸 아미노산과 당은 능동수송 단백질을 통해 세포 내로 운반된다.[6][7]
탄수화물 분해 편집
일반적인 탄수화물의 화학식은 CX(H2YOY)이며, 단량체(monomer) 역시도 비슷하다. 탄수화물을 더 작은 단위로 분해하는 과정에서, 결합체가 가지고 있는 많은 양의 에너지를 추출하기 위해 대게 단당류로 소화된 다음 세포로 유입된다.[8] 세포로 들어온 단당류(포도당이나 과당)는 해당과정을 거치면서 피루브산으로 전환되고 ATP가 만들어진다.[9] 피루브산은 몇몇 대사 회로의 중간체이지만 대부분의 경우 아세틸 조효소 A(아세틸-CoA)로 전환되어 시트르산 회로로 들어간다. 시트르산 회로에서 ATP가 더 많이 생산되기는 하지만, 이 회로에서 가장 중요한 생산물은 아세틸-CoA가 산화되면서 NAD+에서 생산된 NADH이다. 무산소 조건에서는 젖산 탈수소효소의 작용으로 해당과정을 통해 젖산이 생산되고, NADH는 해당과정에서 재사용되기 위해서 NAD+로 재산화된다. 포도당은 오탄당 인산 경로라는 다른 경로로 분해될 수도 있다. 오탄당 인산 경로는 조효소 NADPH를 환원하고, 핵산의 구성 성분인 리보스와 같은 오탄당을 생산하는 과정이다.
지방 분해 편집
지방은 라이페이스에 의해 지방산과 글리세롤로 가수분해된다. 글리세롤은 해당과정으로 들어가고 지방산은 베타 산화 과정을 통하여 분해되어 아세틸-CoA를 방출하고, 시트르산 회로에 진입한다. 지방산이 산화되면 산소를 더 많이 가지고 있는 탄수화물보다 더 많은 에너지를 방출할 수 있다. 스테로이드 또한 베타 산화와 유사한 과정을 통해 몇몇 세균에 의해 분해되어 상당한 양의 아세틸-CoA, 프로피오닐-CoA, 피루브산으로 전환되고, 이들은 모두 세포가 에너지를 얻는 데에 쓸 수 있다. 결핵균(M. tuberculosis)은 탄소원으로 콜레스테롤만을 이용하여 증식할 수 있으며, 콜레스테롤 사용 경로와 관련된 유전자가 결핵균이 감염되는 생활사의 여러 단계에서 중요한 역할을 한다는 것이 확인되었다.[10]
단백질 분해 편집
단백질은 아미노산 및 기타 단순한 화합물로 분해되는데, 여기서 생성된 단순한 아미노산은 세포막을 통해 세포내외로 운반되며 RNA 및 리보솜의 중합반응을 통해 새로운 단백질로 합성된다. 아미노산은 또한 에너지원으로 사용되어 요소와 이산화 탄소로 산화된다.[11] 아미노산의 산화 경로는 아미노기 전이효소에 의해 아미노기를 제거하면서 시작한다. 아미노기는 요소 회로로 들어가고, 아미노기가 제거된 탄소 골격은 케토산의 형태로 남는다. 이 케토산 중에 몇몇은 시트르산 회로의 중간체로, 예를 들어 글루탐산이 탈아미노화되면 α-케토글루타르산이 된다.[12] 어떤 아미노산은 포도당신생합성 과정을 통해 포도당으로 전환될 수 있는데, 이를 당생성 아미노산이라 한다.[13]
에너지 전환 편집
산화적 인산화 편집
산화적 인산화에서, 유기 분자로부터 제거된 전자는 산소로 전달되고 방출된 에너지는 ATP를 만드는데 사용된다. 이것은 진핵 생물에서 전자전달계라고 불리는 미토콘드리아 막의 일련의 단백질에 의해 수행된다. 원핵 생물에서는 이 단백질들이 세포내막에서 발견된다. 이 단백질들은 전자를 전달함으로써 방출되는 에너지를 이용하며, 미토콘드리아의 막에 걸쳐있다.
양성자의 이동에 의해 미토콘드리아 내막을 기준으로 양성자 농도 차이가 발생하고 전기 화학적 구배가 생성된다. 이 힘은 양성자를 ATP 합성효소라 불리는 효소를 통해 미토콘드리아 안쪽으로 돌려보낸다. 이 양성자 흐름은 ATP 합성효소의 활성 부위의 모양을 변화시키고, 아데노신 이인산을 인산화하여 ATP를 합성한다.
빛 에너지 편집
햇빛 에너지는 식물, 시아노 박테리아, 자주색 박테리아, 녹색 황 박테리아 및 일부 원생생물에 의해 받아들여진다. 이 과정은 종종 광합성의 일부로서 이산화탄소를 유기 화합물로 전환시키는 것과 관련이 있다. 그러나 자주색 박테리아와 녹색 황 박테리아는 햇빛을 에너지원으로 사용할 수 있고, 탄소 고정과 유기 화합물의 발효 사이를 전환시킬 수 있기 때문에 에너지 생성 및 탄소 고정 시스템은 원핵생물에서는 별도로 작동될 수 있다.
많은 유기체가 태양 에너지를 받아들이는 과정은 산화적 인산화와 유사하다. 이것은 양성자 농도 구배로서 에너지를 저장하기 때문이다. 이 양성자로 인한 힘은 ATP 합성을 유도한다. 이 전자전달계를 돌리는데 필요한 전자는 광합성 반응 센터 혹은 로돕신이라고 불리는 집광 단백질에서 나온다.
식물, 조류 및 시아노 박테리아에서 광계 II는 빛 에너지를 사용하여 물에서 전자를 제거하여 산소를 폐기물로 방출한다. 그런 다음 전자는 시토크롬 b6f 복합체로 이동하며, 이 에너지는 엽록체의 틸라코이드의 막을 가로질러 양성자를 펌핑해내기 위해 사용된다. 이들 양성자는 막을 통해 ATP 합성효소를 통과한다. 그 후 전자들은 광계 I로 흐르며 칼빈 회로에 사용하기 위해 코엔자임 NADP +를 감소 시키거나 추가 ATP 생성을 위해 재활용될 수 있다.
동화작용 편집
동화작용은 이화작용에서 방출된 에너지로 복잡한 분자를 합성하는데 이용하는 대사 과정이다. 일반적으로 세포의 구조를 이루는 복잡한 분자는 작고 단순한 전구물질로부터 차례로 합성된다. 합성대사는 기본적으로 세 단계를 거친다. 처음에는 아미노산, 단당류, 테르페노이드, 뉴클레오타이드와 같은 전구물질을 생산하고, 그 다음에는 ATP에 저장된 에너지를 이용하여 전구물질을 활성이 있는 형태로 바꾼다. 마지막으로 이 전구물질들을 조립하여 단백질, 다당류, 지질, 핵산 등의 복잡한 분자들을 생산한다.
생물에 따라 스스로 세포 내에서 만들 수 있는 분자들의 종류가 각기 다르다. 식물과 같은 자가영양생물은 이산화 탄소나 물처럼 간단한 분자에서 다당류나 단백질을 합성할 수 있다. 반면에 종속영양생물은 보다 복잡한 물질을 합성하기 위한 전구물질들, 예컨대 단당류나 아미노산을 필요로 한다. 생물은 궁극적인 에너지원에 따라 더 세분화된다.
광합성 편집
광합성은 햇빛과 이산화탄소(CO 2)에서 탄수화물을 합성하는 과정이다. 식물, 시아노 박테리아 및 조류에서 산소 광합성은 폐기물로서 생성된 산소와 함께 물을 분할하게 된다. 이 과정은 앞서 설명한 바와 같이 광합성 반응 센터에 의해 생성된 ATP 및 NADPH를 사용하여 이산화탄소를 3-포스포글리세르산으로 바꾼 다음 글루코스로 변환시킬 수 있다. 식물에서 광합성의 세 가지 타입, 즉 C3 탄소 고정, C4 탄소 고정, CAM 광합성이 일어난다. 이는 이산화탄소가 캘빈 사이클로 이동하는 경로에 따라 달라지는데, C3 식물은 CO2를 직접 고정하는 반면, C4와 CAM 광합성은 강렬한 햇빛과 건조한 조건에 대처하기 위한 적응으로서 CO2를 다른 화합물에 먼저 통합한다.[14]
광합성 원핵생물에서는 탄소 고정의 메커니즘이 더 다양하다. 여기서 이산화탄소는 캘빈 – 벤슨 사이클, 역 구연산 사이클 또는 아세틸-CoA의 카르복시화에 의해 고정될 수 있다. 원핵화학요법도 칼빈-벤송 사이클을 통해 CO2를 고정시키지만, 무기 화합물로부터의 에너지를 사용하여 반응을 유도한다.
탄수화물과 글리칸 편집
탄수화물 아나볼리즘에서는 간단한 유기산을 포도당과 같은 단당체로 변환한 뒤 녹말과 같은 다당체를 조립하는 데 사용할 수 있다. 피루베이트, 젖산, 글리세롤, 글리세레이트 3인산, 아미노산과 같은 화합물에서 포도당이 생성되는 것을 글루코네제네시스라고 한다. 글루코네제네시스(Gluconeogenesis)는 일련의 매개체를 통해 피루베이트를 포도당-6-인산염으로 변환하는데, 이 중 상당수는 글리콜리시스(glycolyis)와 공유된다.[15] 그러나, 이 통로는 단순히 글라이코시스가 아닌 효소에 의해 여러 단계가 촉매되기 때문에 역방향으로 운영되는 것이 아니다. 이는 포도당의 형성과 분해를 별도로 규제할 수 있게 하고, 두 경로가 헛된 순환에서 동시에 달리는 것을 막아주기 때문에 중요하다.[16][17]
지방은 에너지를 저장하는 일반적인 방법이지만 인간과 같은 척추동물에서는 이러한 유기체가 아세틸-CoA를 피루베이트로 변환할 수 없기 때문에 글루코네제네시스(글루코네제네시스)를 통해 포도당으로 변환할 수 없다. 그러나 동물들은 그렇지 않다.[18] 그 결과, 장기간 굶은 후 척추동물은 지방산을 대사시킬 수 없는 뇌와 같은 조직에서 포도당을 대체하기 위해 지방산에서 케톤체를 생산해야 한다.[19] 식물이나 박테리아와 같은 다른 유기체에서는 이 대사 문제를 글리옥실산 주기의 데카르복실화 단계를 우회하여 아세틸-CoA를 포도당 생산에 사용할 수 있는 옥살로아세테이트로 변환할 수 있게 하는 글리옥실산 주기를 이용하여 해결한다.[20][21]
다당류 및 글리칸은 우리딘 인산염 포도당(UDP-글루코스)과 같은 반응성 설탕-인산염 기증자에서 성장하는 다당류에서 수용성 히드록실 그룹에 글리코실트전달효소에 의해 순차적으로 첨가되어 만들어진다. 기질 고리에 있는 히드록실 그룹 중 어느 하나라도 수용체가 될 수 있기 때문에 생산되는 다당류는 직선 구조나 갈림 구조를 가질 수 있다.[22] 생산되는 다당류는 그 자체로 구조적 또는 대사 기능을 가질 수 있거나, 올리고차릴전달효소라는 효소에 의해 지질이나 단백질로 전이될 수 있다.
지방산, 이소프로노이드 및 스테로이드 편집
지방산은 중합된 후 아세틸-CoA 단위를 감소시키는 지방산 시네타스에 의해 만들어진다. 지방산의 아킬 사슬은 아킬 그룹을 더하여 알코올로 줄이고 알켄 그룹으로 탈수시킨 다음 다시 알칸 그룹으로 감소시키는 반응의 순환에 의해 확장된다. 지방산 생합성의 효소는 두 그룹으로 나뉜다: 동물과 곰팡이에서는 이 모든 지방산 신타아제 반응이 단일 다기능성 I형 단백질에 의해 수행되는 반면, 식물에서는 플라스티드와 박테리아 분리형 II형 효소는 경로상 각 단계를 수행한다.[23][24]
테르페네와 이소프로노이드(Terpenes and Isoprenoids)는 카로티노이드(Carrootnode)를 포함하고 있으며 식물 천연물의 가장 큰 부류를 형성하고 있는 지질의 큰 부류다.[25] 이러한 화합물은 반응성 전구체 이소펜테닐 피로인산염과 디메틸알릴 피로인산염으로부터 기증된 이소프렌 단위의 조립과 개조에 의해 만들어진다.[26] 이러한 전구체는 다양한 방법으로 만들 수 있다. 동물과 고고학에서 메발론산염 통로는 아세틸-CoA로부터 이러한 화합물을 생성하는 반면, 식물과 박테리아에서는 비메발론산 통로는 피루브산염과 글리세랄알데히드 3-인산염을 기질로 사용한다.[27][28] 이러한 활성 이솝렌 기증자를 이용하는 중요한 반응 중 하나는 스테로이드 생합성이다. 여기서 이솝렌 단위는 함께 결합하여 스칼렌을 만든 다음 접어서 한 세트의 링으로 형성되어 라노스테롤을 만든다.[29] 라노스테롤은 콜레스테롤이나 에고스테롤과 같은 다른 스테로이드제로 전환될 수 있다.[30][31]
단백질 편집
유기체는 20개의 일반적인 아미노산을 합성하는 능력에 있어 다양하다. 대부분의 박테리아와 식물은 20개 모두를 합성할 수 있지만 포유류는 11개의 비필수 아미노산만 합성할 수 있기 때문에 9개의 필수 아미노산을 식품에서 얻어야 한다.[32] 미코플라즈마 진폐로니아 박테리아와 같은 일부 단순한 기생충은 아미노산 합성이 모두 부족하여 숙주로부터 아미노산을 직접 가져간다.[33] 모든 아미노산은 글리콜리시스, 구연산 주기 또는 펜토오스 인산염 경로의 중간체로부터 합성된다. 질소는 글루탐산염과 글루타민에 의해 공급된다. 아미노산 합성은 적절한 알파-케토산의 형성에 따라 달라지는데, 이 알파-케토산은 아미노산을 형성하기 위해 전이된다.[34]
아미노산은 펩타이드 결합의 체인에 함께 결합되어 단백질로 만들어진다. 각각의 다른 단백질은 아미노산 잔류물의 고유한 순서를 가지고 있다: 이것이 그것의 일차적인 구조다. 알파벳의 글자들이 결합되어 거의 끝없는 다양한 단어들을 형성할 수 있는 것처럼, 아미노산은 다양한 배열로 연결되어 매우 다양한 단백질을 형성할 수 있다. 단백질은 에스테르 결합을 통해 RNA 분자에 부착되어 활성화되어 있는 아미노산으로 만들어진다. 이 아미노산-tRNA 전구체는 아미노산 tRNA 합성효소에 의해 수행되는 ATP 의존적 반응으로 생성된다.[35] 이때 이 아미노실-tRNA는 리보솜의 기질이 되어, 전령 RNA의 시퀀스 정보를 이용하여 아미노산을 연장 단백질 사슬에 결합시킨다.[36]
뉴클레오티드 합성 및 인양 편집
뉴클레오티드는 다량의 신진대사에너지를 필요로 하는 경로에서 아미노산, 이산화탄소, 폼산으로 만들어진다.[37] 따라서 대부분의 유기체는 미리 형성된 뉴클레오티드를 구하는 효율적인 시스템을 가지고 있다.[38][39] 퓨린은 뉴클레오시드(리보스에 부착된 bases)로 합성된다. 아데닌과 구아닌은 모두 아미노산 글리신, 글루타민, 아스파르트산 등의 원자와 코엔자임 사트라하이드로폴로부터 전달되는 포메이테이트를 이용하여 합성되는 전구 뉴클레오시드 인산염으로 만들어진다. 반면에 피리미딘은 글루타민과 아스파르테이트로부터 형성되는 염기성 오로테이트로부터 합성된다.[40]
해독 그리고 산화 환원 대사 편집
모든 유기체는 식품으로 사용할 수 없는 화합물에 지속적으로 노출되며 대사 기능이 없어 세포에 축적되면 해로울 수 있다. 이러한 잠재적으로 손상될 수 있는 화합물은 유전생물체라고 불린다.[41] 합성약물, 천연독물, 항생제와 같은 제노바이오틱스는 일련의 제노바이오틱스-메타볼링 효소에 의해 해독된다. 인간의 경우 시토크롬 P450 산화제,[42] UDP-글루코노실 전이제,[43] 및 글루타티온 S 전이제가 포함된다.[44] 이 효소 체계는 3단계로 작용하여 우선 유전생물학(위상Ⅰ)을 산화시킨 다음 수용성 그룹을 분자(위상Ⅱ)에 결합시킨다. 변형 수용성 이종 생물학은 세포에서 퍼낼 수 있고 다세포 유기체에서는 배설되기 전에 추가로 대사될 수 있다(단계 III). 생태학에서 이러한 반응은 오염물질의 미생물 생물분해와 오염된 토지의 생물분해와 기름 유출에 특히 중요하다.[45] 이러한 미생물 반응의 많은 부분이 다세포 유기체와 공유되지만, 미생물 유형의 믿을 수 없을 정도로 다양하기 때문에 이 유기체는 다세포 유기체보다 훨씬 광범위한 범위의 이종균제를 다룰 수 있고, 유기농 화합물과 같은 지속적인 유기 오염물질도 저하시킬 수 있다.[46]
유산소 생물의 관련 문제는 산화 스트레스다.[47] 여기서 산화인산화, 단백질 접힘 중 이황화 결합의 형성을 포함한 공정은 과산화수소 등 활성산소를 생성한다.[48] 글루타티온과 같은 항산화 대사물과 카탈라이나 과산화효소와 같은 효소에 의해 이러한 손상 산화제가 제거된다.
생물체의 열역학 편집
살아있는 유기체는 열과 일의 전달을 기술하는 열역학 법칙을 준수해야 한다. 열역학 제2법칙은 어떤 폐쇄적 시스템에서도 엔트로피(방전)의 양이 감소할 수 없다고 명시하고 있다. 생물체의 놀라운 복잡성이 이 법칙과 모순되는 것처럼 보이지만, 모든 유기체는 물질과 에너지를 주변과 교환하는 열린 시스템이기 때문에 생명체는 가능하다. 따라서 생물체계는 평형 상태에 있지 않고 오히려 환경의 엔트로피를 더 크게 증가시킴으로써 그들의 높은 복잡성의 상태를 유지하는 소멸적 시스템이다.[49] 세포의 신진대사는 자발적인 강직증 과정과 비협직적인 아나볼리즘 과정을 결합함으로써 이를 달성한다. 열역학적으로 볼 때 신진대사는 장애를 일으켜 질서를 유지한다.[50]
규제 및 통제 편집
대부분의 유기체의 환경이 끊임없이 변화하고 있기 때문에 신진대사의 반응을 미세하게 조절하여 세포 내에서 일정한 조건들을 유지시켜야 하는데, 이는 바로 동종요법이라고 하는 질환이다.[51][52] 대사 조절은 또한 유기체가 신호에 반응하고 환경과 능동적으로 상호작용할 수 있도록 한다.[53] 두 가지 밀접하게 연계된 개념은 대사 경로를 어떻게 통제하는지를 이해하는 데 중요하다. 첫째로, 경로에서 효소의 조절은 신호에 반응하여 효소의 활동을 증가시키고 감소시키는 방법이다. 둘째로, 이 효소에 의해 발휘되는 조절은 이러한 활동 변화가 경로의 전체 속도(경로를 통과하는 유동)에 미치는 영향이다.[54] 예를 들어 효소는 활동에서 큰 변화를 보일 수 있지만(즉, 그것은 매우 조절된다) 이러한 변화가 대사 경로의 유동성에 거의 영향을 미치지 않는다면, 이 효소는 경로의 통제에 관여하지 않는다.[55]
대사 조절에는 여러 가지 레벨이 있다. 내인성 규제에서, 대사 경로 자기 조절은 기질이나 제품의 수준의 변화에 반응한다. 예를 들어, 제품의 양의 감소는 보상 경로를 통해 유속을 증가시킬 수 있다. 이러한 유형의 규제는 경로상 다중 효소의 활동에 대한 알로스테릭적인 규제에 수반되는 경우가 많다.[56] 외적 조절은 다세포 유기체의 세포가 다른 세포로부터의 신호에 반응하여 신진대사를 변화시키는 것을 포함한다. 이러한 신호는 보통 호르몬이나 성장인자와 같은 수용성 메신저의 형태로 세포 표면의 특정 수용체에 의해 감지된다.[57] 이 신호들은 종종 단백질의 인산화 작용을 수반하는 두 번째 메신저 시스템에 의해 세포 내부에서 전달된다.[58]
외인성 조절의 아주 잘 알려진 예는 인슐린 호르몬에 의한 포도당 대사의 조절이다.[59] 인슐린은 혈당 수치의 상승에 대응하여 생성된다. 그 호르몬을 세포에 인슐린 수용체에 결합시키면 세포가 포도당을 차지하게 하고 지방산, 글리코겐과 같은 저장 분자로 전환시키는 일련의 단백질 키나제를 활성화시킨다.[60] 글리코겐의 신진대사는 글리코겐을 분해하는 효소인 인산화효소와 그것을 만드는 효소인 글리코겐신화효소의 활성으로 조절된다. 이러한 효소는 인산화제가 글리코겐 싱타아제를 억제하지만 인산화효소를 활성화하는 등 호혜적인 방식으로 조절된다. 인슐린은 단백질 인산염을 활성화하고 이러한 효소의 인산화 감소를 발생시킴으로써 글리코겐 합성을 유발한다.[61]
진화 편집
글리콜리시스, 구연산 순환과 같이 위에서 설명한 신진대사의 중심 경로는 생물의 세 영역 모두에 존재하며 마지막 보편적 공통 조상에 존재했다.[62][63] 이 보편적인 조상 세포는 원핵이었고 아마도 광범위한 아미노산, 뉴클레오티드, 탄수화물, 지질대사를 가진 메타노겐이었을 것이다.[64][65] 나중에 진화하는 동안 이러한 고대 경로의 유지는 글리콜리시스 및 구연산 사이클과 같은 경로가 그들의 최종 제품을 매우 효율적이고 최소의 단계로 생산하면서 그들의 특정한 대사 문제에 대한 최적의 해결책이었을 수 있다.[66][67] 효소 기반 신진대사의 첫 번째 경로는 푸린 뉴클레오티드 신진대사의 일부였을지 모르지만, 이전의 대사 경로는 고대 RNA 세계의 일부였다.[68]
새로운 신진대사 경로가 진화하는 메커니즘을 설명하기 위해 많은 모델들이 제안되었다. 여기에는 새로운 효소를 짧은 조상의 경로에 순차적으로 추가하는 것, 전체 경로의 중복과 분리는 물론, 기존의 효소와 그 결합을 새로운 반응 경로로 채용하는 것 등이 포함된다.[69] 이러한 메커니즘의 상대적 중요성은 불분명하지만, 길 속의 효소가 공유 조상을 가질 가능성이 높다는 게 게 게놈 연구결과에 따르면, 많은 경로가 길의 기존 단계에서 생성된 새로운 기능을 가지고 단계별로 진화해 왔음을 시사한다.[70] 대안 모델은 대사 네트워크에서 단백질 구조의 진화를 추적하는 연구에서 나온 것으로, 이는 효소가 침투하여 다른 대사 경로에서 유사한 기능을 수행하기 위해 효소를 차용한다는 것을 시사했다[71] 이러한 모집 과정은 진화 enz를 낳는다.얀 모자이크[72] 세 번째 가능성은 신진대사의 일부 부분이 다른 경로에 재사용될 수 있고 다른 분자에 대해 유사한 기능을 수행할 수 있는 "모듈"로서 존재할 수 있다는 것이다.[73]
신진대사 경로의 진화뿐만 아니라, 진화는 신진대사 기능의 상실을 초래할 수도 있다. 예를 들어, 생존에 필수적이지 않은 일부 기생충 대사 과정에서는 소실되고 미리 형성된 아미노산, 뉴클레오티드, 탄수화물을 숙주로부터 대신 캐낼 수 있다.[74] 유사한 대사능력의 감소는 내분비생물체에서 볼 수 있다.[75]
조사 및 조작 편집
고전적으로 신진대사는 하나의 신진대사 경로에 초점을 맞춘 환원주의적 접근법에 의해 연구된다. 특히 중요한 것은 전구체, 조직, 세포 수준에서 방사능 추적기를 사용하는 것으로, 전파자로부터 최종 생산물까지의 경로를 무선 활성 라벨 중간자와 제품을 식별하여 정의한다.[76] 이러한 화학반응을 촉진하는 효소는 정제될 수 있고, 그 작용과 억제제에 대한 반응을 조사할 수 있다. 평행 접근은 세포나 조직의 작은 분자를 식별하는 것이다; 이러한 분자의 완전한 집합을 대사물이라고 부른다. 전반적으로 이러한 연구들은 단순한 신진대사 경로의 구조와 기능을 잘 볼 수 있게 해주지만, 완전한 세포의 신진대사 같은 보다 복잡한 시스템에 적용할 때는 불충분하다.[77]
수천 개의 서로 다른 효소를 포함하는 세포 내 대사 네트워크의 복잡성에 대한 아이디어는 오른쪽의 43개의 단백질과 40개의 대사물들 사이의 상호작용을 보여주는 그림으로 주어진다: 게놈의 순서는 45,000개의 유전자를 포함하는 어떤 것도 포함하는 목록을 제공한다.[78] 그러나 이제 이 게놈 데이터를 사용하여 생화학반응의 완전한 네트워크를 재구성하고 이들의 행동을 설명하고 예측할 수 있는 보다 총체적인 수학적 모델을 생산할 수 있게 되었다.[79] 이러한 모델은 고전적인 방법을 통해 얻은 경로와 대사물 데이터를 단백질 및 DNA 미세배열 연구의 유전자 발현 데이터와 통합하는 데 사용할 때 특히 강력하다.[80] 이러한 기법을 이용하여 이제 인간 신진대사의 모델이 생산되어 미래의 약물 발견과 생화학적 연구를 지도하게 된다.[81] 이러한 모델은 현재 네트워크 분석에서 인간의 질병을 공통 단백질이나 대사물을 공유하는 집단으로 분류하는데 사용된다.[82][83]
박테리아 대사망은 비교적 적은 중간 공통 통화를 사용하여 광범위한 영양소를 투입하고 다양한 제품과 복잡한 고분자를 생산할 수 있는 구조인 나비타이[84][85] 조직의 두드러진 예다.
이 정보의 주요한 기술적 적용은 신진대사 공학이다. 여기서 효모, 식물 또는 박테리아와 같은 유기체를 유전적으로 변형시켜 생명공학에 더욱 유용하게 만들고 항생제 같은 약품이나 1,3 프로파네디올과 시키미산과 같은 공업용 화학물질의 생산을 돕는다.[86] 이러한 유전자변형은 일반적으로 제품을 생산하는 데 사용되는 에너지의 양을 줄이고, 수확량을 증가시키며, 폐기물의 생산을 감소시키는 것을 목적으로 한다.[87]
역사 편집
신진대사라는 용어는 그리스 μεαββλμμμό μ – "변화" 또는 "오버던"을 뜻하는 "메타볼리스모스"에서 유래되었다.[88]
그리스 철학 편집
아리스토텔레스의 <동물의 부분들>은 열린 흐름 모델이 만들어질 수 있도록 신진대사에 대한 그의 견해에 대한 충분한 세부사항을 제시한다. 그는 그 과정의 각 단계에서 음식에서 나오는 물질들이 변형되어 열이 불의 고전적인 원소로 배출되고, 잔여 물질들은 소변이나 담즙, 또는 배설물로 배출된다고 믿었다.[89]
과학적 방법의 적용 편집
신진대사에 대한 과학적 연구의 역사는 수 세기에 걸쳐 있으며 초기 연구에서 동물 전체를 검사하는 것에서 현대 생화학에서의 개별적인 대사반응을 검사하는 것으로 옮겨갔다. 인간의 신진대사에 대한 최초의 통제된 실험은 1614년 산토리오 산토리오가 그의 저서 아르스 데 스테티나 메디치나에 발표하였다.[90] 그는 먹고 자고 일하고 섹스하고 단식하고 마시고 배설하기 전과 후에 몸무게가 얼마나 나갔는지를 묘사했다. 그는 자신이 섭취한 음식의 대부분이 이른바 '감각할 수 없는 땀'을 통해 상실된다는 것을 발견했다.
이러한 초기 연구들에서, 이러한 대사 과정의 메커니즘은 확인되지 않았으며 생명력 있는 힘이 살아있는 조직에 생기를 불어넣는 것으로 생각되었다. 19세기, 효모에 의한 알코올에 대한 설탕의 발효를 연구할 때 루이 파스퇴르는 발효가 자신이 "발효"라고 부르는 효모세포 내의 물질에 의해 촉매작용을 한다고 결론지었다. 그는 "알코올 발효는 효모세포의 생명과 조직과 상관관계가 있는 행위로서 세포의 죽음이나 퍼트 리액션과 관련이 없다."[91] 이 발견은 1828년 프리드리히 뵐러가 요소 화학합성에 관한 논문[92]에서 발표한 것과 함께, 최초의 유기화합물로 주목할 만하다.롬은 완전히 무기체 전구체다. 이것은 세포에서 발견되는 유기화합물과 화학반응이 원칙적으로 화학의 다른 부분과 다르지 않다는 것을 증명했다.
신진대사의 화학반응에 대한 연구와 세포의 생물학적 연구를 분리하고 생화학학의 시작을 알린 것은 20세기 초 에두아르 부치너에 의한 효소의 발견이었다.[93] 생화학적 지식의 질량은 20세기 초엽에 걸쳐 급속도로 성장하였다. 이러한 현대 생화학자들 중 가장 다작인 한스 크렙스는 신진대사를 연구하는 데 큰 공헌을 한 사람이었다.[94] 그는 요소 순환을 발견하였고 후에 한스 콘버그와 함께 구연산 순환과 글리옥실산 순환을 연구하였다.[95][96] 현대의 생화학적 연구는 크로마토그래피, X선 회절, NMR 분광학, 방사성 동위원소 라벨링, 전자 현미경 및 분자역학 시뮬레이션과 같은 새로운 기법의 개발에 크게 도움을 받았다. 이러한 기술들은 세포의 많은 분자와 대사 경로에 대한 발견과 상세한 분석을 가능하게 했다.
같이 보기 편집
각주 편집
- ↑ Nealson K, Conrad P (1999). "Life: past, present and future". Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923–39. doi:10.1098/rstb.1999.0532. PMC 1692713. PMID 10670014.
- ↑ Nelson N, Ben-Shem A (2004). "The complex architecture of oxygenic photosynthesis". Nat Rev Mol Cell Biol. 5 (12): 971–82. doi:10.1038/nrm1525. PMID 15573135
- ↑ Häse, C. C.; Finkelstein, R. A. (1993년 12월 1일). “Bacterial extracellular zinc-containing metalloproteases.”. 《Microbiology and Molecular Biology Reviews》 (영어) 57 (4): 823–837. ISSN 1092-2172. PMID 8302217.
- ↑ Gupta, R.; Gupta, N.; Rathi, P. (2004년 6월 1일). “Bacterial lipases: an overview of production, purification and biochemical properties”. 《Applied Microbiology and Biotechnology》 (영어) 64 (6): 763–781. doi:10.1007/s00253-004-1568-8. ISSN 1432-0614.
- ↑ Hoyle, Terence (1997년 12월 11일). “The digestive system: linking theory and practice”. 《British Journal of Nursing》 6 (22): 1285–1291. doi:10.12968/bjon.1997.6.22.1285. ISSN 0966-0461.
- ↑ Souba, Wiley W.; Pacitti, Anthony J. (1992). “Review: How Amino Acids Get Into Cells: Mechanisms, Models, Menus, and Mediators”. 《Journal of Parenteral and Enteral Nutrition》 (영어) 16 (6): 569–578. doi:10.1177/0148607192016006569. ISSN 1941-2444.
- ↑ Barrett, Michael P; Walmsleyt, Adrian R; Gould, Gwyn W (1999년 8월 1일). “Structure and function of facultative sugar transporters”. 《Current Opinion in Cell Biology》 (영어) 11 (4): 496–502. doi:10.1016/S0955-0674(99)80072-6. ISSN 0955-0674.
- ↑ Bell, G. I.; Burant, C. F.; Takeda, J.; Gould, G. W. (1993년 9월 15일). “Structure and function of mammalian facilitative sugar transporters.”. 《Journal of Biological Chemistry》 (영어) 268 (26): 19161–19164. ISSN 0021-9258. PMID 8366068.
- ↑ Bouché, Clara; Serdy, Shanti; Kahn, C. Ronald; Goldfine, Allison B. (2004년 10월 1일). “The Cellular Fate of Glucose and Its Relevance in Type 2 Diabetes”. 《Endocrine Reviews》 (영어) 25 (5): 807–830. doi:10.1210/er.2003-0026. ISSN 0163-769X.
- ↑ Wipperman, Matthew F.; Sampson, Nicole S.; Thomas, Suzanne T. (2014년 7월 1일). “Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis”. 《Critical Reviews in Biochemistry and Molecular Biology》 49 (4): 269–293. doi:10.3109/10409238.2014.895700. ISSN 1040-9238. PMC 4255906. PMID 24611808.
- ↑ Sakami, W; Harrington, H (1963년 6월 1일). “Amino Acid Metabolism”. 《Annual Review of Biochemistry》 32 (1): 355–398. doi:10.1146/annurev.bi.32.070163.002035. ISSN 0066-4154. 2022년 6월 23일에 원본 문서에서 보존된 문서. 2020년 5월 15일에 확인함.
- ↑ Brosnan, John T. (2000년 4월 1일). “Glutamate, at the Interface between Amino Acid and Carbohydrate Metabolism”. 《The Journal of Nutrition》 (영어) 130 (4): 988S–990S. doi:10.1093/jn/130.4.988S. ISSN 0022-3166.
- ↑ Young, Vernon R.; Ajami, Alfred M. (2001년 9월 1일). “Glutamine: The Emperor or His Clothes?”. 《The Journal of Nutrition》 (영어) 131 (9): 2449S–2459S. doi:10.1093/jn/131.9.2449S. ISSN 0022-3166.
- ↑ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). "Crassulacean acid metabolism: plastic, fantastic". J Exp Bot. 53 (369): 569–80. doi:10.1093/jexbot/53.369.569. PMID 11886877
- ↑ Bouché C, Serdy S, Kahn C, Goldfine A (2004). "The cellular fate of glucose and its relevance in type 2 diabetes". Endocr Rev. 25 (5): 807–30. doi:10.1210/er.2003-0026. PMID 15466941. Archived from the original on 4 December 2012. Retrieved 15 March 2007.
- ↑ Boiteux A, Hess B (1981). "Design of glycolysis". Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5–22. Bibcode:1981RSPTB.293....5B
- ↑ Pilkis S, el-Maghrabi M, Claus T (1990). "Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics". Diabetes Care. 13 (6): 582–99. doi:10.2337/diacare.13.6.582
- ↑ Ensign S (2006). "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation". Mol Microbiol. 61 (2): 274–6. doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935
- ↑ Finn P, Dice J (2006). "Proteolytic and lipolytic responses to starvation". Nutrition. 22 (7–8): 830–44. doi:10.1016/j.nut.2006.04.008. PMID 16815497
- ↑ Ensign S (2006). "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation". Mol Microbiol. 61 (2): 274–6. doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935
- ↑ Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988–91. Bibcode:1957Natur.179..988K. doi:10.1038/179988a0. PMID 13430766
- ↑ Rademacher T, Parekh R, Dwek R (1988). "Glycobiology". Annu Rev Biochem. 57: 785–838. doi:10.1146/annurev.bi.57.070188.004033. PMID 3052290. Opdenakker G, Rudd P, Ponting C, Dwek R (1993). "Concepts and principles of glycobiology". FASEB J. 7 (14): 1330–7. doi:10.1096/fasebj.7.14.8224606. PMID 8224606
- ↑ White S, Zheng J, Zhang Y (2005). "The structural biology of type II fatty acid biosynthesis". Annu Rev Biochem. 74: 791–831. doi:10.1146/annurev.biochem.74.082803.133524. PMID 15952903
- ↑ Ohlrogge J, Jaworski J (1997). "Regulation of fatty acid synthesis". Annu Rev Plant Physiol Plant Mol Biol. 48: 109–136. doi:10.1146/annurev.arplant.48.1.109. PMID 15012259
- ↑ Dubey V, Bhalla R, Luthra R (2003). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). J Biosci. 28 (5): 637–46. doi:10.1007/BF02703339. PMID 14517367. Archived from the original (PDF) on 15 April 2007.
- ↑ Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units". Nat Prod Rep. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695
- ↑ Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units". Nat Prod Rep. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695
- ↑ Lichtenthaler H (1999). "The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annu Rev Plant Physiol Plant Mol Biol. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203
- ↑ Schroepfer G (1981). "Sterol biosynthesis". Annu Rev Biochem. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367
- ↑ Schroepfer G (1981). "Sterol biosynthesis". Annu Rev Biochem. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367
- ↑ Lees N, Skaggs B, Kirsch D, Bard M (1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review". Lipids. 30 (3): 221–6. doi:10.1007/BF02537824. PMID 7791529
- ↑ Nelson DL, Cox MM (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. p. 841. ISBN 978-0-7167-4339-2.
- ↑ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (November 1996). "Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae". Nucleic Acids Res. 24 (22): 4420–49. doi:10.1093/nar/24.22.4420. PMC 146264. PMID 8948633
- ↑ Guyton AC, Hall JE (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. pp. 855–6. ISBN 978-0-7216-0240-0.
- ↑ Ibba M, Söll D (2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Rep. 2 (5): 382–7. doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928. Archived from the original on 1 May 2011.
- ↑ Lengyel P, Söll D (1969). "Mechanism of protein biosynthesis". Bacteriol Rev. 33 (2): 264–301. doi:10.1128/MMBR.33.2.264-301.1969. PMC 378322. PMID 4896351
- ↑ Rudolph F (1994). "The biochemistry and physiology of nucleotides". J Nutr. 124 (1 Suppl): 124S–127S. doi:10.1093/jn/124.suppl_1.124S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). "Pyrimidine and purine biosynthesis and degradation in plants". Annu Rev Plant Biol. 57: 805–36. doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783
- ↑ Rudolph F (1994). "The biochemistry and physiology of nucleotides". J Nutr. 124 (1 Suppl): 124S–127S. doi:10.1093/jn/124.suppl_1.124S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). "Pyrimidine and purine biosynthesis and degradation in plants". Annu Rev Plant Biol. 57: 805–36. doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783
- ↑ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). "Purine and pyrimidine nucleotide metabolism in higher plants". J Plant Physiol. 160 (11): 1271–95. doi:10.1078/0176-1617-01169. PMID 14658380
- ↑ Smith J (1995). "Enzymes of nucleotide synthesis". Curr Opin Struct Biol. 5 (6): 752–7. doi:10.1016/0959-440X(95)80007-7. PMID 8749362
- ↑ Testa B, Krämer S (2006). "The biochemistry of drug metabolism—an introduction: part 1. Principles and overview". Chem Biodivers. 3 (10): 1053–101. doi:10.1002/cbdv.200690111. PMID 17193224
- ↑ Danielson P (2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Curr Drug Metab. 3 (6): 561–97. doi:10.2174/1389200023337054. PMID 12369887
- ↑ King C, Rios G, Green M, Tephly T (2000). "UDP-glucuronosyltransferases". Curr Drug Metab. 1 (2): 143–61. doi:10.2174/1389200003339171. PMID 11465080.
- ↑ Sheehan D, Meade G, Foley V, Dowd C (November 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". Biochem J. 360 (Pt 1): 1–16. doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986
- ↑ Galvão T, Mohn W, de Lorenzo V (2005). "Exploring the microbial biodegradation and biotransformation gene pool". Trends Biotechnol. 23 (10): 497–506. doi:10.1016/j.tibtech.2005.08.002. PMID 16125262
- ↑ Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). "Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities" (PDF). Environ Microbiol. 7 (12): 1868–82. doi:10.1111/j.1462-2920.2005.00966.x. PMID 16309386
- ↑ Davies K (1995). "Oxidative stress: the paradox of aerobic life". Biochem Soc Symp. 61: 1–31. doi:10.1042/bss0610001. PMID 8660387.
- ↑ Tu B, Weissman J (2004). "Oxidative protein folding in eukaryotes: mechanisms and consequences". J Cell Biol. 164 (3): 341–6. doi:10.1083/jcb.200311055. PMC 2172237. PMID 14757749
- ↑ von Stockar U, Liu J (1999). "Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth". Biochim Biophys Acta. 1412 (3): 191–211. doi:10.1016/S0005-2728(99)00065-1. PMID 10482783
- ↑ Demirel Y, Sandler S (2002). "Thermodynamics and bioenergetics". Biophys Chem. 97 (2–3): 87–111. doi:10.1016/S0301-4622(02)00069-8. PMID 12050002
- ↑ Albert R (2005). "Scale-free networks in cell biology". J Cell Sci. 118 (Pt 21): 4947–57. arXiv:q-bio/0510054. Bibcode:2005q.bio....10054A. doi:10.1242/jcs.02714. PMID 16254242
- ↑ Brand M (1997). "Regulation analysis of energy metabolism". J Exp Biol. 200 (Pt 2): 193–202. PMID 9050227
- ↑ Soyer O, Salathé M, Bonhoeffer S (2006). "Signal transduction networks: topology, response and biochemical processes". J Theor Biol. 238 (2): 416–25. doi:10.1016/j.jtbi.2005.05.030. PMID 16045939
- ↑ Salter M, Knowles R, Pogson C (1994). "Metabolic control". Essays Biochem. 28: 1–12. PMID 7925313
- ↑ Westerhoff H, Groen A, Wanders R (1984). "Modern theories of metabolic control and their applications (review)". Biosci Rep. 4 (1): 1–22. doi:10.1007/BF01120819. PMID 6365197
- ↑ Fell D, Thomas S (1995). "Physiological control of metabolic flux: the requirement for multisite modulation". Biochem J. 311 (Pt 1): 35–9. doi:10.1042/bj3110035. PMC 1136115. PMID 7575476
- ↑ Hendrickson W (2005). "Transduction of biochemical signals across cell membranes". Q Rev Biophys. 38 (4): 321–30. doi:10.1017/S0033583506004136. PMID 16600054
- ↑ Cohen P (2000). "The regulation of protein function by multisite phosphorylation—a 25 year update". Trends Biochem Sci. 25 (12): 596–601. doi:10.1016/S0968-0004(00)01712-6. PMID 11116185
- ↑ Lienhard G, Slot J, James D, Mueckler M (1992). "How cells absorb glucose". Sci Am. 266 (1): 86–91. Bibcode:1992SciAm.266a..86L. doi:10.1038/scientificamerican0192-86. PMID 1734513
- ↑ Roach P (2002). "Glycogen and its metabolism". Curr Mol Med. 2 (2): 101–20. doi:10.2174/1566524024605761. PMID 11949930
- ↑ Newgard C, Brady M, O'Doherty R, Saltiel A (2000). "Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1" (PDF). Diabetes. 49 (12): 1967–77. doi:10.2337/diabetes.49.12.1967. PMID 11117996
- ↑ Smith E, Morowitz H (2004). "Universality in intermediary metabolism". Proc Natl Acad Sci USA. 101 (36): 13168–73. Bibcode:2004PNAS..10113168S. doi:10.1073/pnas.0404922101. PMC 516543. PMID 15340153
- ↑ Romano A, Conway T (1996). "Evolution of carbohydrate metabolic pathways". Res Microbiol. 147 (6–7): 448–55. doi:10.1016/0923-2508(96)83998-2. PMID 9084754
- ↑ Koch A (1998). How did bacteria come to be?. Adv Microb Physiol. Advances in Microbial Physiology. 40. pp. 353–99. doi:10.1016/S0065-2911(08)60135-6. ISBN 978-0-12-027740-7. PMID 9889982
- ↑ Ouzounis C, Kyrpides N (1996). "The emergence of major cellular processes in evolution". FEBS Lett. 390 (2): 119–23. doi:10.1016/0014-5793(96)00631-X. PMID 8706840
- ↑ Ebenhöh O, Heinrich R (2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bull Math Biol. 63 (1): 21–55. doi:10.1006/bulm.2000.0197. PMID 11146883
- ↑ Meléndez-Hevia E, Waddell T, Cascante M (1996). "The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution". J Mol Evol. 43 (3): 293–303. Bibcode:1996JMolE..43..293M. doi:10.1007/BF02338838. PMID 8703096
- ↑ Caetano-Anolles G, Kim HS, Mittenthal JE (2007). "The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture". Proc Natl Acad Sci USA. 104 (22): 9358–63. Bibcode:2007PNAS..104.9358C. doi:10.1073/pnas.0701214104. PMC 1890499. PMID 17517598
- ↑ Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). "Metabolites: a helping hand for pathway evolution?". Trends Biochem Sci. 28 (6): 336–41. doi:10.1016/S0968-0004(03)00114-2. PMID 12826406
- ↑ Light S, Kraulis P (2004). "Network analysis of metabolic enzyme evolution in Escherichia coli". BMC Bioinformatics. 5: 15. doi:10.1186/1471-2105-5-15. PMC 394313. PMID 15113413. Alves R, Chaleil R, Sternberg M (2002). "Evolution of enzymes in metabolism: a network perspective". J Mol Biol. 320 (4): 751–70. doi:10.1016/S0022-2836(02)00546-6. PMID 12095253.
- ↑ Kim HS, Mittenthal JE, Caetano-Anolles G (2006). "MANET: tracing evolution of protein architecture in metabolic networks". BMC Bioinformatics. 7: 351. doi:10.1186/1471-2105-7-351. PMC 1559654. PMID 16854231
- ↑ Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). "Small-molecule metabolsim: an enzyme mosaic". Trends Biotechnol. 19 (12): 482–6. doi:10.1016/S0167-7799(01)01813-3. PMID 11711174
- ↑ Spirin V, Gelfand M, Mironov A, Mirny L (June 2006). "A metabolic network in the evolutionary context: Multiscale structure and modularity". Proc Natl Acad Sci USA. 103 (23): 8774–9. Bibcode:2006PNAS..103.8774S. doi:10.1073/pnas.0510258103. PMC 1482654. PMID 16731630
- ↑ Lawrence J (2005). "Common themes in the genome strategies of pathogens". Curr Opin Genet Dev. 15 (6): 584–8. doi:10.1016/j.gde.2005.09.007. PMID 16188434. Wernegreen J (2005). "For better or worse: genomic consequences of intracellular mutualism and parasitism". Curr Opin Genet Dev. 15 (6): 572–83. doi:10.1016/j.gde.2005.09.013. PMID 16230003
- ↑ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). "Chance and necessity in the evolution of minimal metabolic networks". Nature. 440 (7084): 667–70. Bibcode:2006Natur.440..667P. doi:10.1038/nature04568. PMID 16572170
- ↑ Rennie M (1999). "An introduction to the use of tracers in nutrition and metabolism". Proc Nutr Soc. 58 (4): 935–44. doi:10.1017/S002966519900124X. PMID 10817161
- ↑ Phair R (1997). "Development of kinetic models in the nonlinear world of molecular cell biology". Metabolism. 46 (12): 1489–95. doi:10.1016/S0026-0495(97)90154-2. PMID 9439549
- ↑ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). "How many genes are there in plants (... and why are they there)?". Curr Opin Plant Biol. 10 (2): 199–203. doi:10.1016/j.pbi.2007.01.004. PMID 17289424
- ↑ Borodina I, Nielsen J (2005). "From genomes to in silico cells via metabolic networks". Curr Opin Biotechnol. 16 (3): 350–5. doi:10.1016/j.copbio.2005.04.008. PMID 15961036
- ↑ Gianchandani E, Brautigan D, Papin J (2006). "Systems analyses characterize integrated functions of biochemical networks". Trends Biochem Sci. 31 (5): 284–91. doi:10.1016/j.tibs.2006.03.007. PMID 16616498
- ↑ Duarte NC, Becker SA, Jamshidi N, et al. (February 2007). "Global reconstruction of the human metabolic network based on genomic and bibliomic data". Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777–82. Bibcode:2007PNAS..104.1777D. doi:10.1073/pnas.0610772104. PMC 1794290. PMID 17267599
- ↑ Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (May 2007). "The human disease network". Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685–90. Bibcode:2007PNAS..104.8685G. doi:10.1073/pnas.0701361104. PMC 1885563. PMID 17502601
- ↑ Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (July 2008). "The implications of human metabolic network topology for disease comorbidity". Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880–9885. Bibcode:2008PNAS..105.9880L. doi:10.1073/pnas.0802208105. PMC 2481357. PMID 1859944
- ↑ Csete M, Doyle J (2004). "Bow ties, metabolism and disease". Trends Biotechnol. 22 (9): 446–50. doi:10.1016/j.tibtech.2004.07.007. PMID 15331224
- ↑ Ma HW, Zeng AP (2003). "The connectivity structure, giant strong component and centrality of metabolic networks". Bioinformatics. 19 (11): 1423–30. CiteSeerX 10.1.1.605.8964. doi:10.1093/bioinformatics/btg177. PMID 12874056
- ↑ Thykaer J, Nielsen J (2003). "Metabolic engineering of beta-lactam production". Metab Eng. 5 (1): 56–69. doi:10.1016/S1096-7176(03)00003-X. PMID 12749845. González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). "Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol". Metab Eng. 7 (5–6): 329–36. doi:10.1016/j.ymben.2005.06.001. hdl:10400.14/3388. PMID 16095939. Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). "Metabolic engineering for microbial production of shikimic acid". Metab Eng. 5 (4): 277–83. doi:10.1016/j.ymben.2003.09.001. PMID 14642355
- ↑ Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). "Metabolic engineering". Annu Rev Biomed Eng. 1: 535–57. doi:10.1146/annurev.bioeng.1.1.535. PMID 11701499
- ↑ "Metabolism". The Online Etymology Dictionary. Retrieved 20 February 2007.
- ↑ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. pp. 400–401. ISBN 978-1-4088-3622-4.
- ↑ Eknoyan G (1999). "Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies". Am J Nephrol. 19 (2): 226–33. doi:10.1159/000013455. PMID 10213823
- ↑ Dubos J. (1951). "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind". Trends Biotechnol. 13 (12): 511–515. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136
- ↑ Kinne-Saffran E, Kinne R (1999). "Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs". Am J Nephrol. 19 (2): 290–4. doi:10.1159/000013463. PMID 10213830
- ↑ Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 20 March 2007
- ↑ Kornberg H (2000). "Krebs and his trinity of cycles". Nat Rev Mol Cell Biol. 1 (3): 225–8. doi:10.1038/35043073. PMID 11252898
- ↑ Krebs HA, Henseleit K (1932). "Untersuchungen über die Harnstoffbildung im tierkorper". Z. Physiol. Chem. 210 (1–2): 33–66. doi:10.1515/bchm2.1932.210.1-2.33. Krebs H, Johnson W (April 1937). "Metabolism of ketonic acids in animal tissues". Biochem J. 31 (4): 645–60. doi:10.1042/bj0310645. PMC 1266984. PMID 16746382
- ↑ Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988–91. Bibcode:1957Natur.179..988K. doi:10.1038/179988a0. PMID 13430766