아세트산
이 문서는 영어 위키백과의 Acetic acid 문서를 번역하여 문서의 내용을 확장할 필요가 있습니다. |
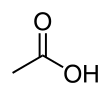
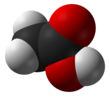
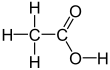
아세트산(acetic acid) 또는 초산(醋酸)은 대표적인 카복실산 중 하나이다. 시성식은 CH3COOH이다. 식초의 주성분으로 3~5%정도 함유되어 있어[9]식초의 신맛을 내기 때문에 초산이라고도 한다. 레몬 등의 과일에 소량 들어있기도 한다. 순수한 것은 어는점이 높아 겨울철에 쉽게 고체 상태로 되므로 빙초산(氷醋酸)이라고도 한다.
| |||
| |||

| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Acetic acid[3] | |||
| 체계명
Ethanoic acid | |||
| 별칭 | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 약어 | AcOH | ||
| 506007 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.528 | ||
| EC 번호 |
| ||
| E 번호 | E260 (방부제) | ||
| 1380 | |||
| KEGG | |||
| MeSH | Acetic+acid | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 2789 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C2H4O2 | |||
| 몰 질량 | 60.052 g·mol−1 | ||
| 겉보기 | Colourless liquid | ||
| 냄새 | Heavily vinegar-like | ||
| 밀도 | 1.049 g cm−3 (liquid); 1.27 g cm−3 (solid) | ||
| 녹는점 | 16 to 17 °C; 61 to 62 °F; 289 to 290 K | ||
| 끓는점 | 118 to 119 °C; 244 to 246 °F; 391 to 392 K | ||
| Miscible | |||
| log P | -0.28[4] | ||
| 산성도 (pKa) | |||
| 염기도 (pKb) | 9.24 (basicity of acetate ion) | ||
| 짝염기 | 아세테이트 | ||
자화율 (χ)
|
-31.54·10−6 cm3/mol | ||
굴절률 (nD)
|
1.371 (VD = 18.19) | ||
| 점도 | 1.22 mPa s | ||
| 1.74 D | |||
| 열화학 | |||
열용량 (C)
|
123.1 J K−1 mol−1 | ||
표준 몰 엔트로피 (S
|
158.0 J K−1 mol−1 | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
-483.88–483.16 kJ mol−1 | ||
표준 연소 엔탈피 (ΔcH⦵298)
|
-875.50–874.82 kJ mol−1 | ||
| 약리학 | |||
| G01AD02 (WHO) S02AA10 | |||
| 위험 | |||
| GHS 그림문자 |  
| ||
| 신호어 | 위험 | ||
| H226, H314 | |||
| P280, P305+351+338, P310 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | 40 °C (104 °F; 313 K) | ||
| 427 °C (801 °F; 700 K) | |||
| 폭발 한계 | 4–16% | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
3.31 g kg−1, oral (rat) | ||
LC50 (median concentration)
|
5620 ppm (mouse, 1 hr) 16000 ppm (rat, 4 hr)[8] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 10 ppm (25 mg/m3)[7] | ||
REL (권장)
|
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[7] | ||
IDLH (직접적 위험)
|
50 ppm[7] | ||
| 관련 화합물 | |||
관련 카복실산
|
폼산 프로피온산 | ||
관련 화합물
|
아세트알데하이드 아세트아마이드 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
특성 편집
물리적 성질 편집
상온에서는 무색의 자극성 강한 냄새를 가진 신맛이 있는 액체로 존재한다. 녹는점은 16.7 °C, 끓는점은 118.1 °C이다.[10] 임계 온도는 321.5 °C이고 임계 압력은 57.2기압이다. 연소열은 209.4kcal이며 증발열은 85cal/g, 융해열은 44.7cal/g이다. 물, 알코올, 에테르 등에 잘 녹고 유기 용매에도 잘 녹는다.[9] 황, 인 등의 유기 화합물을 녹이기 때문에 용매로 사용된다.[10]
수소 원자를 제외하고는 모든 원자가 한 평면위에 있다. C-C 결합 길이는 1.54±0.04Å, C=O는 1.24±0.03Å, C-O는 1.43±0.03Å이다. 분자 간에는 수소 결합이 강하게 작용하며, 일부는 이합체를 형성하고 있다.[9]
화학적 성질 편집
폭발범위의 하한은 4.0%이며, 인화점은 41.7 °C이다. 자연발화온도는 566 °C이다. 대부분의 금속과 염을 만드며, 물과 혼합할 경우 부식성이 높은 용액을 만든다. 태울 경우 푸른 불꽃을 내며 타고 이산화탄소와 물이 생성된다.[9]
아세트산의 이온화 상수는 1.8X10-5으로 비교적 약산으로 분류된다.[11] 아세트산은 일양성자산으로, 탄소 원자와 결합하고 있는 세 개의 수소 원자는 해리되지도 않고 금속으로 치환되지도 않는다.[10] 물에 녹으면 산성을 띈다.
아세트산이 관여된 반응으로는 대표적으로 다음과 같은 것이 있다.[10]
- 염기, 산화물, 탄산염, 황화물, 금속 등과 반응하여 아세트산염을 생성한다.
- 알코올과 반응하여 에스터를 생성한다.
- 삼염화 인과 반응하여 염화아세틸(CH3COCl)을 생성한다. 염화아세틸은 아세틸기 전이 반응을 위한 시약으로 사용된다.
- 촉매 존재 하에 석회와 반응하면 아세톤과 탄산 칼슘이 생성된다.
- 염소와 반응하여 클로로아세트산, 다이클로로아세트산, 트라이클로로아세트산을 만든다.
호흡 반응 편집
아세트산은 일부 호흡 반응에 쓰일 수 있는데 그 반응식은 다음과 같다.
- CH3COOH + 2O2 → 2CO2 + 2H2O + E
제조법 편집
아세트산 발효 편집
-Bacterium aceti와 같은 세균은 에탄올과 산소를 이용하여 아세트산 발효를 일으켜 아세트산을 생산할 수 있다. 반응식은 다음과 같다.
맥주나 포도주 등의 알코올성 음료를 오래 놔둘 경우 시어질 때가 있는데, 이 역시 같은 원인으로 아세트산이 생성되었기 때문이다.[10]
메탄올과 일산화탄소로의 합성 편집
아세트산을 합성하는 방법 중 하나는 메탄올과 일산화탄소로부터 직접적으로 아세트산을 합성하는 방법이다. 반응식은 다음과 같다.
이 반응은 약 650기압 정도의 고압에 약 250 °C의 온도에서 진행되며 아이오딘화 코발트를 촉매로 하여 액체상에서 진행된다. 반응이 완료되면 생성물은 촉매로부터 분리되고 정제되어 99.8%의 순도를 가진 아세트산이 완성된다.[10]
그 외의 방법 편집
그 외 아세트산을 제작하는 방법으로는 다음과 같은 것이 주로 사용된다.[9]
용도 편집
생체 내에서의 작용 편집
아세트산은 체내에서 당, 아미노산, 지방 등의 대사의 결과 생성되기도 한다.
알코올성 음료를 마시면 체내에 에탄올이 들어오게 되는데, 이는 알코올 수소이탈효소에 의하여 아세트알데하이드가 된다. 아세트알데하이드는 다시 알데하이드 수소이탈효소 등에 의해 아세트산으로 바뀌게 된다. 이렇게 해서 생성된 아세트산은 아세틸-CoA 등으로 바뀌어 TCA 회로에 투입되어 ATP 생산에 사용되거나 다른 대사과정에 사용된다.[9]
섭취 편집
삼킬 경우 심각한 손상과 이에 따른 사망을 야기할 수 있다. 목에 통증, 구토, 설사 등이 일어날 수 있다. 1.0ml 정도의 적은 양을 삼킨다고 하여도 식도궤양을 일으킬 수 있다.[12]
흡입 편집
고농도의 증기를 흡입할 경우 코 안쪽, 목, 폐에 심각한 손상을 입힐 수 있다. 호흡 곤란이 일어날 수 있다. 자극의 정도나 냄새로 농도를 가늠하는 것은 좋은 방법이 아니다.[12]
피부 편집
고농도의 용액에 접촉하였을 경우 심각한 피부의 손상을 입힐 수 있다. 발작, 통증이 일어날 수 있다. 고농도의 증기와 접촉할 경우 피부가 민감해질 수 있다.[12]
눈 편집
고농도의 용액에 접촉하였을 경우 눈에 심각한 손상을 입힐 수 있고 심할 경우 실명에까지 이를 수 있다. 증기에 노출될 경우 눈물을 흘리거나 자극을 받을 수 있다.[12]
각주 편집
- ↑ 《Scientific literature reviews on generally recognised as safe (GRAS) food ingredients》. National Technical Information Service. 1974. 1쪽.
- ↑ "Chemistry", volume 5, Encyclopædia Britannica, 1961, page 374
- ↑ 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The 왕립화학회. 2014. 745쪽. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ↑ “acetic acid_msds”.
- ↑ Haynes, William M., 편집. (2016). 《CRC Handbook of Chemistry and Physics》 97판. CRC 프레스. 5–88쪽. ISBN 9781498754293.
- ↑ Bordwell, F. G.; Algrim, Donald (1976). “Nitrogen acids. 1. Carboxamides and sulfonamides”. 《The Journal of Organic Chemistry》 41 (14): 2507–2508. doi:10.1021/jo00876a042.
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0002”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ “Acetic acid”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 가 나 다 라 마 바 사 化學大辭典編集委員會 편, 성용길, 김창홍 역, 〈아세트산〉, 《화학대사전》(Vol. 5), 서울: 世和, 2001, 689~690쪽.
- ↑ 가 나 다 라 마 바 사 Considine, G. D. et al., "ACETIC ACID", Van Nostrand's encyclopedia of chemistry, 5th edition, Hoboken: Wiley-Interscience, 2005, pp. 6~7.
- ↑ Parker, S. P. et al., "Acetic acid", McGraw-Hill encyclopedia of chemistry, New York: McGraw-Hill, 1993, p. 5.
- ↑ 가 나 다 라 “아세트산 MSDS”. 2008년 6월 2일에 원본 문서에서 보존된 문서. 2008년 6월 1일에 확인함.
참고 문헌 편집
- Considine, G. D. et al., Van Nostrand's encyclopedia of chemistry, 5th edition, Hoboken: Wiley-Interscience, 2005.
- Parker, S. P. et al., McGraw-Hill encyclopedia of chemistry, New York: McGraw-Hill, 1993.
- 化學大辭典編集委員會 편, 성용길, 김창홍 역, 《화학대사전》, 서울: 世和, 2001.
- https://web.archive.org/web/20080602132156/http://www.jtbaker.com/msds/englishhtml/a0326.htm