폐섬유증
폐섬유증(肺纖維症, 영어: pulmonary fibrosis)은 폐 조직이 굳어서 심각한 호흡 장애를 불러일으키는 호흡기 질환이다. 폐가 굳는다 함은 섬유질 결합조직의 과다누적을 의미하며 이 과정을 섬유화라고 한다. 섬유화가 진행되면 폐벽이 두꺼워져 혈액에 공급되는 산소량이 줄어든다. 그 결과 환자는 지속적으로 끔찍한 숨가쁨을 느끼게 된다.[1]
 | |
|---|---|
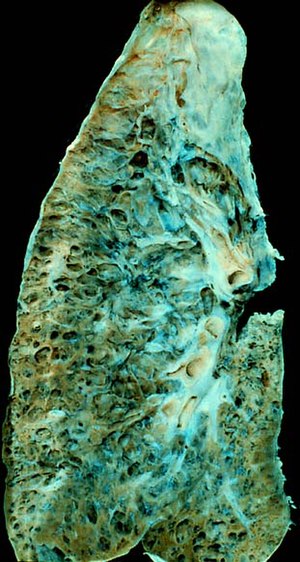 | |
| 말기 폐섬유증 환자의 폐. | |
| 진료과 | 호흡기내과 |
섬유화의 명확한 이유를 진단할 수 있는 환자들도 있지만, 그 원인을 밝혀내지 못하는 경우도 있는데 이런 경우를 특발성 폐섬유증이라고 한다. 폐섬유증으로 인해 섬유화가 진행된 폐조직을 복구할 수 있는 방법은 없다.[2]
징후 및 증상 편집
폐 섬유증의 증상은 주로 다음과 같다.[3]
- 호흡곤란(특히 운동을 할 때)
- 만성건조와 헛기침
- 피로
- 가슴의 통증을 수반한 답답함
- 식욕 상실 및 급격한 체중 감소
폐 섬유증은 과로와 함께 진행되는 호흡곤란 증상으로 진찰 될 수 있다. 때때로 청진 시 폐 기저부에서 미세한 흡기의 딱딱한 소리가 들릴 수 있다. 흉부 X-ray 상으로는 정상 또는 비정상으로 나타날 수 있지만 CT상에서는 비정상적인 폐의 모습을 볼 수 있다.[4]
원인 편집
폐 섬유증은 다른 질병으로부터의 합병증일 수 있다. 이들 중 대부분은 간질성 폐질환으로 분류된다. 예로서 자가면역증상, 바이러스 감염 및 결핵과 같은 박테리아 감염이 포함되며, 이는 폐의 상엽 또는 하엽 모두에서 섬유성 변화 및 폐에 대한 미세한 손상을 유발할 수 있다. 하지만 폐 섬유증은 밝혀지지 않은 원인에 의해 나타나기도 하는데 이런 경우를 "특발성"이라고 한다.[5] 대부분의 특발성 사례는 특발성 폐섬유증으로 진단된다. 이는 일반적인 간질성 폐렴으로 알려진 일련의 조직학적/병리학적 특징을 배제한다. 두 경우 모두 환자의 하위 집합에서 유전적 소인을 가리키는 증거가 늘어나고 있다. 예를 들어, 계면활성제 단백질(SP-C)의 돌연변이는 폐 섬유증의 병력이 있는 일부 가족 내에 존재하는 것으로 보고되었다.[6] 텔로머레이즈를 코딩하는 TERC또는 TERT유전자의 상염색체 우성 돌연변이가 폐 섬유증 환자의 약 15%에서 확인되었다.[7]
2차 합병증으로 폐 섬유증을 유발할 수 있는 질병 및 상태는 다음과 같다.[4][6]
- 직업이나 환경으로 인한 금속이나 특정 기체에 대한 노출에 의한 석면폐증, 규폐증.[8] 특히 광부, 선박 노동자 등은 더 높은 위험 환경에 노출되어 있다.
- 과민성 폐렴, 대부분의 세균, 곰팡이 또는 동물성 제품으로 오염된 먼지 흡입
- 흡연으로 인한 섬유증 유발 가능성 증가와 병세의 악화[5]
- 류마티스 관절염, 강직성 척추염, SLE 및 경피증과 같은 일부 전형적인 결합 조직 질환[5]
- 유육종증 및 다발혈관염을 동반한 육종과 같은 결합 조직과 관련된 기타 질병
- COVID-19를 포함한 감염
- 특정 약물 ; 아미오다론, 블레오마이신, 부설판, 메토트렉세이트[5], 아포모르핀 및 니트로푸란토인(13)[9]
- 가슴의 방사선 치료
병의 발생 편집
폐 섬유증은 정상적인 폐 실질의 점진적인 섬유조직으로의 교체됨과 관련있다. 폐 섬유증을 포함한 기관의 섬유증은 만성 염증보다는 비정상적인 상처 치유에 의한 세포 외 기질(ECM)의 과도한 축적에서 기인하고, 장기 기능의 손상으로 이어지며 결과적으로 높은 이환율 및 사망률을 나타낸다.[10][11] 이때 TGF-β를 통한 신호전달 경로는 섬유성 병변의 주요 요인으로 알려져 있으며 실제로 TGF-β경로를 차단함은 인간 폐 섬유아세포에서 강력한 항섬유화 효과를 발휘한다.[12] 정상적인 폐를 흉터 조직으로 대체하면 산소 확산 능력이 비가역적으로 감소하고 결과적으로 경직되거나 감소된 순응도가 폐 섬유증을 제한성 폐질환으로 만든다.[13]
진단 편집
폐 생검으로 진단할 수 있으며,[4] 정확한 진단을 내리기 위해 충분한 조직을 얻기 위해서 전신마취를 동반한 영상 보조 흉강경 생검을 요할 수 있다. 이러한 종류의 생검은 흉벽을 통해 여러 개의 튜브를 배치하는 것과 관련되며, 그 중 하나는 평가를 위해 보낼 폐 조각을 잘라내는 데 사용된다. 제거된 조직을 현미경을 통한 조직병리학적으로 검사 하여 섬유증의 존재 및 패턴, 그리고 특정 원인을 나타낼 수 있는 특징을 확인한다.
전반적으로 폐 섬유증이 드물지는 않지만 각 개별 유형의 섬유증은 흔하지 않으며 환자에 대한 평가는 복잡하고 다분야의 접근이 필요하가 때문에 오진도 종종 일어난다.[14]
폐활량 측정에서 제한적 폐 질환으로서 FEV1(1초 간 강제 호기량)과 FVC(강제 폐활량)가 모두 감소하므로 FEV1/FVC 비율은 정상이거나 이 비율이 다음과 같은 폐쇄성 폐 질환과 대조적으로 증가한다.
치료 편집
폐 섬유증은 흉터 조직을 만들고, 흉터는 영구적이다. 진행을 늦추고 예방하는 방법 또한 원인에 따라 달라진다.
- 특발성 폐섬유증 치료의 선택은 매우 제한적이다. 연구가 진행 중 이지만 상태를 유의미하게 호전 시킬 수 있는 약물은 보고 되지 않았다. 심각한 상태의 경우 폐 이식이 유일한 선택지이다. 일부 유형의 폐 섬유증은 프레드니손(prednisone)과 같은 코르티코스테로이드 및 면역 체계를 억제하는 기타 약물에 반응할 수 있으므로 이러한 유형의 약물은 섬유증으로 이어지는 과정을 늦추기 위해 처방 될 수도 있다.[15]
- 면역 체계는 여러 형태의 폐 섬유증 발병에서 중요한 역할을 하는 것으로 보이는데, 코르티코스테로이드와 같은 면역 억제제를 사용한 치료의 목표는 폐 염증과 그에 따른 흉터를 줄이는 것을 목적으로 한다. 치료에 대한 반응은 다양한데, 특발성 폐 섬유증은 뚜렷한 치료법이 아직 없기 때문에 면역 억제 치료를 통해 상태가 호전 되는 환자의 경우 특발성 폐 섬유증이 아닐 가능성이 높다.
- 경미한 특발성 섬유증에서 흉터 예방에 대한 약리학적 제제로서 피르페니돈(pirfenidone)이 있다. 이는 걷기 테스트에서 효과를 보였지만 호흡기 증상에는 영향을 미치지 않는다. 두 번째로 닌테다닙 (nintedanib)은 다양한 타이로신 카이네이즈 수용체(tyrosine kinase receptor)의 억제를 통한 효과를 유도하며, 임상 시험에서 폐 기능 저하와 급성 악화를 감소 시키는 것으로 나타났다.[16]
- 항염증제는 섬유화 과정을 늦추는데 제한적인 효과를 보였다. 비특이적 간질성 폐렴과 같은 일부 다른 유형의 섬유증은 코르티코스테로이드와 같은 면역억제 요법에 반응할 수 있다. 그러나 소수의 환자만이 코르티코스테로이드 단독으로 반응하므로 사이클로포스파미드, 아자티오프린, 메토트렉세이트, 페니실라민, 사이클로스포린과 같은 추가 면역억제제를 사용할 수 있다. 콜히친 또한 제한적으로 성공으로 사용되었다.[4] IFN-γ와 같은 새로운 약물에 대한 실험도 진행 중에 있다.
- 과민성 폐렴은 원인 물질과의 접촉을 피함으로써 악화되는 것을 방지할 수 있다.
예후 편집
폐 섬유증으로 인한 저산소증은 폐 고혈압을 유발할 수 있으며, 이는 차례로 우심실의 심부전으로 이어질 수 있다. 저산소증은 산소 보충으로 예방할 수 있다.[4]
역학 편집
전 세계적으로 500만 명 이상이 폐 섬유증을 앓고 있다. 아래의 비율은 100,000명 당 사람 수이다.
또한 폐 섬유증은 COVID-19에서 알려진 증상 중 하나이며 COVID-19로 입원한 환자의 약 1/3에서 발생하는 것으로 추정된다.(2020년 7월 기준)[17]
| 발병률 | 유병률 | 인구 | 적용 년도 | 참조 |
|---|---|---|---|---|
| 6.8-16.3 | 14.0-42.7 | U.S. health care claims processing system | 1996-2000 | Raghu et al.[18] |
| 8.8-17.4 | 27.9-63.0 | Olmsted County, MN | 1997-2005 | Fernandez Perez et al.[19] |
| 27.5 | 30.3 | Males in Bernalillo County, NM | 1988-1990 | Coultas et al.[20] |
| 11.5 | 14.5 | Females |
위의 통계에 따르면, 미국의 폐 섬유증 유병률은 2000년의 18세 이상 인구를 기준으로 29,000명 이상에서 약132,000명까지 여러 연령대에 거쳐 나타난다. 위에서 언급한 대로 오진으로 인하여 실제 환자는 훨씬 더 높을 수 있다. 일반적으로 진단시 환자는 40, 50대이며, 특발성 폐섬유증의 발병률은 50대 이후 급격히 증가한다. 그러나 대부분의 폐 기능의 상실은 일반적으로 노화, 심장 질환 또는 다른 흔한 폐 질환으로 인한 것이다.
전망 편집
이러한 폐 섬유증의 연구는 생검을 통해 얻은 조직을 통해 실시하거나 세포 주를 사용하게 된다.
몇몇 연구에서 줄기세포, 특히 중간엽 줄기 세포를 환자의 정맥 내로 투여하여 폐섬유증 치료에 사용한 최근 임상 시험이 이루어졌고 폐 기능이 증가함을 관찰한 바 있다.[10] 이러한 중간엽 줄기 세포를 통한 효과는 손상된 세포를 이들 세포가 대체하기 때문이라고 여겨졌으나, 최근 연구에서 일련의 사이토카인이나 세포 외 소포로 구성된 세크레톰의 직접적인 세포 간 상호작용 또는 분비를 통해 조직 복구를 촉진 및 면역조절 효과를 나타낸다고 보고했다.[21] 또한 섬유아세포 성장인자(FGF), 간세포 성장인자(HGF), 표피 성장인자(EGF)등의 성장 인자를 분비하여 재상피화 및 혈관신생을 촉진한다.
또 다른 연구에서는 중간엽 줄기세포에서 손상된 세포로의 커넥신 매개 세포간 채널 또는 세포외 소포를 통한 직접적인 미토콘드리아 전달을 통해 수용 세포의 ATP 저장을 회복하고 세포 기능을 복구할 수 있다는 증거를 제시했다.[22]
최근 오가노이드(organoid)에 대한 연구가 활발히 이어지고 있고, 이는 폐 섬유증 뿐만 아니라 다양한 질병 모델을 만드는 데 있어서 도움을 줄 것으로 기대된다. 최종적으로는 환자의 세포로부터 유도된 유도만능줄기세포를 이용하여 인공 폐를 생성하고 이식할 수 있는 기술에 도달할 것으로 보인다.
또한 폐 섬유증에 대해 Fibroblast activation protein 등의 세포 막 발현 단백질에 대한 연구가 이어지고 있으며 또한 대식세포(Macrophage)의 유형에 따른 섬유증 유발에 대한 연구도 활발히 진행 중에 있다.[23]
주 편집
- ↑ Mayo Clinic Staff. “Definition [of pulmonary fibrosis]”. Mayo Foundation for Medical Education and Research. 2014년 7월 26일에 확인함.
- ↑ “Pulmonary Fibrosis”. MedicineNet, Inc. 2014년 7월 26일에 확인함.
- ↑ “Symptoms”.
- ↑ 가 나 다 라 마 바 “Pulmonary Fibrosis”.
- ↑ 가 나 다 라 “Pulmonary Fibrosis”.
- ↑ 가 나 “Causes”. 《MAYO CLINIC》.
- ↑ “Idiopathic pulmonary fibrosis”. 《MedlinePlus Trusted Health Information for you》.
- ↑ Hubbard, R.; Cooper, M.; Antoniak, M.; Venn, A.; Khan, S.; Johnston, I.; Lewis, S.; Britton, J. (2000년 2월 5일). “Risk of cryptogenic fibrosing alveolitis in metal workers”. 《Lancet (London, England)》 355 (9202): 466–467. doi:10.1016/S0140-6736(00)82017-6. ISSN 0140-6736. PMID 10841131.
- ↑ Goemaere, Natascha N. T.; Grijm, Karin; van Hal, Peter Th W.; den Bakker, Michael A. (2008년 5월 21일). “Nitrofurantoin-induced pulmonary fibrosis: a case report”. 《Journal of Medical Case Reports》 2: 169. doi:10.1186/1752-1947-2-169. ISSN 1752-1947. PMC 2408600. PMID 18495029.
- ↑ 가 나 Wiśniewska, Joanna; Sadowska, Agnieszka; Wójtowicz, Anna; Słyszewska, Magda; Szóstek-Mioduchowska, Anna (2021년 10월 11일). “Perspective on Stem Cell Therapy in Organ Fibrosis: Animal Models and Human Studies”. 《Life (Basel, Switzerland)》 11 (10): 1068. doi:10.3390/life11101068. ISSN 2075-1729. PMC 8538998. PMID 34685439.
- ↑ Horowitz, Jeffrey C.; Thannickal, Victor J. (2006). “Idiopathic pulmonary fibrosis : new concepts in pathogenesis and implications for drug therapy”. 《Treatments in Respiratory Medicine》 5 (5): 325–342. doi:10.2165/00151829-200605050-00004. ISSN 1176-3450. PMC 2231521. PMID 16928146.
- ↑ Wójcik-Pszczoła, Katarzyna; Chłoń-Rzepa, Grażyna; Jankowska, Agnieszka; Ślusarczyk, Marietta; Ferdek, Paweł E.; Kusiak, Agnieszka A.; Świerczek, Artur; Pociecha, Krzysztof; Koczurkiewicz-Adamczyk, Paulina (2020년 6월 3일). “A Novel, Pan-PDE Inhibitor Exerts Anti-Fibrotic Effects in Human Lung Fibroblasts via Inhibition of TGF-β Signaling and Activation of cAMP/PKA Signaling”. 《International Journal of Molecular Sciences》 21 (11): E4008. doi:10.3390/ijms21114008. ISSN 1422-0067. PMC 7312375. PMID 32503342.
- ↑ Mayo Foundation for Medical Education and Research. “Complications”.
- ↑ “Pulmonary fibrosis - Diagnosis and treatment - Mayo Clinic”. 2022년 4월 27일에 확인함.
- ↑ Richeldi, L.; Davies, H. R.; Ferrara, G.; Franco, F. (2003). “Corticosteroids for idiopathic pulmonary fibrosis”. 《The Cochrane Database of Systematic Reviews》 (3): CD002880. doi:10.1002/14651858.CD002880. ISSN 1469-493X. PMC 8457302. PMID 12917934.
- ↑ Thomas, Belinda J.; Kan-O, Keiko; Loveland, Kate L.; Elias, Jack A.; Bardin, Philip G. (2016년 12월). “In the Shadow of Fibrosis: Innate Immune Suppression Mediated by Transforming Growth Factor-β”. 《American Journal of Respiratory Cell and Molecular Biology》 55 (6): 759–766. doi:10.1165/rcmb.2016-0248PS. ISSN 1535-4989. PMID 27603223.
- ↑ Vasarmidi, Eirini; Tsitoura, Eliza; Spandidos, Demetrios A.; Tzanakis, Nikolaos; Antoniou, Katerina M. (2020년 9월). “Pulmonary fibrosis in the aftermath of the COVID-19 era (Review)”. 《Experimental and Therapeutic Medicine》 20 (3): 2557–2560. doi:10.3892/etm.2020.8980. ISSN 1792-0981. PMC 7401793. PMID 32765748.
- ↑ Raghu, Ganesh; Weycker, Derek; Edelsberg, John; Bradford, Williamson Z.; Oster, Gerry (2006년 10월 1일). “Incidence and prevalence of idiopathic pulmonary fibrosis”. 《American Journal of Respiratory and Critical Care Medicine》 174 (7): 810–816. doi:10.1164/rccm.200602-163OC. ISSN 1073-449X. PMID 16809633.
- ↑ Fernández Pérez, Evans R.; Daniels, Craig E.; Schroeder, Darrell R.; St Sauver, Jennifer; Hartman, Thomas E.; Bartholmai, Brian J.; Yi, Eunhee S.; Ryu, Jay H. (2010년 1월). “Incidence, prevalence, and clinical course of idiopathic pulmonary fibrosis: a population-based study”. 《Chest》 137 (1): 129–137. doi:10.1378/chest.09-1002. ISSN 1931-3543. PMC 2803118. PMID 19749005.
- ↑ Coultas, D. B.; Zumwalt, R. E.; Black, W. C.; Sobonya, R. E. (1994년 10월). “The epidemiology of interstitial lung diseases”. 《American Journal of Respiratory and Critical Care Medicine》 150 (4): 967–972. doi:10.1164/ajrccm.150.4.7921471. ISSN 1073-449X. PMID 7921471.
- ↑ Li, Xiaoli; Wang, Yan; An, Guoliang; Liang, Di; Zhu, Zhonghui; Lian, Ximeng; Niu, Piye; Guo, Caixia; Tian, Lin (2017년 3월 15일). “Bone marrow mesenchymal stem cells attenuate silica-induced pulmonary fibrosis via paracrine mechanisms”. 《Toxicology Letters》 270: 96–107. doi:10.1016/j.toxlet.2017.02.016. ISSN 1879-3169. PMID 28232222.
- ↑ Morrison, Thomas J.; Jackson, Megan V.; Cunningham, Erin K.; Kissenpfennig, Adrien; McAuley, Daniel F.; O'Kane, Cecilia M.; Krasnodembskaya, Anna D. (2017년 11월 15일). “Mesenchymal Stromal Cells Modulate Macrophages in Clinically Relevant Lung Injury Models by Extracellular Vesicle Mitochondrial Transfer”. 《American Journal of Respiratory and Critical Care Medicine》 196 (10): 1275–1286. doi:10.1164/rccm.201701-0170OC. ISSN 1535-4970. PMC 5694830. PMID 28598224.
- ↑ Prasse, Antje; Pechkovsky, Dmitri V.; Toews, Galen B.; Jungraithmayr, Wolfgang; Kollert, Florian; Goldmann, Torsten; Vollmer, Ekkehard; Müller-Quernheim, Joachim; Zissel, Gernot (2006년 4월 1일). “A vicious circle of alveolar macrophages and fibroblasts perpetuates pulmonary fibrosis via CCL18”. 《American Journal of Respiratory and Critical Care Medicine》 173 (7): 781–792. doi:10.1164/rccm.200509-1518OC. ISSN 1073-449X. PMID 16415274.