화학 전지
화학 전지(化學電池, 영어: electrochemical cell)는 화학 반응을 통해 전기 에너지를 발생시키거나 전기 에너지를 사용하여 화학 반응을 일으키는 장치이다. 전류를 발생시키는 화학 전지는 갈바니 전지라고 하며 이를테면 전기 분해를 통해 화학 반응을 일으키는 전지는 전해 전지라고 부른다.[1][2] 널리 사용되는 갈바니 전지는 표준 1.5 볼트이다.[3]
종류 편집
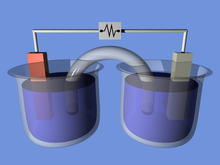
갈바니 전지(볼타 전지) 편집
자발적인 산화-환원 반응을 이용하여 전기를 발생시키는 실험장치를 갈바니 전지(Galvanic cell) 또는 볼타 전지(voltanic cell)라 부른다. 이 이름은 갈바니(Luigi Galavani)와 볼타(Alessandro Volta)가 처음 조립하여 붙여졌다고 한다. 전지구성에서 아연 금속 막대는 ZnSO4 용액에 담겨 있고, 구리 막대는 CuSO4 용액에 담겨 있다. 각 용기에서 아연은 Zn2+으로 산화되고, Cu2+는 Cu로 환원되는 자발적인 반응이 일어남에 따라 외부 도선을 통해 전자가 이동하는 원리에 의해 전지가 작동한다. 여기에서 아연 막대와 구리 막대를 전극(electrode)이라 부른다. 아연과 구리 전극 그리고 ZnSO4, CuSO4으로 이루어진 전지를 다니엘(Daniell)전지라 한다. 이 때, 산화가 일어나는 전극을 산화전극 또는 음극(anode), 환원이 일어나는 전극을 환원전극 또는 양극(cathode)이라고 한다.
다니엘 전지 편집
1836년 영국의 화학자 다니엘(Daniell)은 볼타 전지에서 수소 기체가 발생하여 전압이 떨어지는 분극 현상을 방지하기 위해 다니엘 전지를 고안하였다.다니엘 전지는 두 개의 반쪽 전지로 이루어져 있으며, 황산아연 수용액에 아연 전극을, 황산구리(II) 수용액에 구리 전극을 넣고 염다리로 연결한 전지이다. 다니엘 전지에서, 전극에서 일어나는 산화와 환원 반응인 반쪽 전지반응은 이와 같다.
Zn 전극(산화전극, anode) :
Cu 전극(환원전극, cathode) :
염다리 편집
염다리(salt bridge)는 양이온과 음이온이 한 전극의 칸막이에서 다른 전극의 칸막이로 이동할 수 있게 해주는 전도 매질 역할을 한다. 염다리는 반쪽 전지의 전극 반응에 영향을 주지 않는 염화칼륨(KCl), 황산나트륨(Na2SO4), 질산칼륨(KNO3) 등의 염으로 포화된 한천 수용액을 U자관에 넣어 만들며, 두 전해질이 섞이지 않게 하고, 양쪽 반쪽 전지의 전하가 중성이 되도록 해 주는 역할을 한다.
전체 산화·환원 반응 과정에서 전자들은 외부 도선을 통하여 산화전극으로부터 환원전극으로 흐른다. 용액 속에서 음이온이 산화전극으로 이동하는 동안 양이온은 환원전극으로 이동한다. 그러나 두 용액 사이에 염다리를 연결하지 않으면, 산화전극 부근에서는 Zn2+이온의 생성으로 양전하가 쌓이고 환원전극 부근에서는 Cu2+이온이 Cu로 환원돼서 음전하가 쌓여 전지의 작동이 정지될 수 있다.
전극의 전위와 기전력 편집
표준 환원 전위 편집
전극 전위 편집
화학 전지 내에서 산화·환원 반응이 일어나면서 전자의 이동으로 인해 생기게 되는 두 전극 사이의 전위차를 전지 전위(electrode potential)라고 한다. 전지의 전지 전위는 두 개의 반쪽 전지를 도선으로 연결했을 때 일어나는 전자의 이동으로 인해 생기기 때문에 반쪽 전지만으로는 측정할 수 없다. 따라서 표준 수소 전극을 기준으로 표준 수소 전극과 다른 반쪽 전지로 이루어진 전지의 전지 전위를 측정하여 각 반쪽 전지 전위의 상대적인 크기를 정하게 된다. 이를 그 반쪽 전지의 전극 전위라고 한다.
표준 전극 전위 편집
백금 전극을 사용하여 1M의 H+용액과 접촉하고 있는 1기압의 H2기체로 이루어진 반쪽 전지가 나타내는 전위를 0.00V로 정하는데, 이것을 표준 수소 전극이라고 한다. 반쪽 전지의 전극 전위는 전극을 이루는 물질들의 상대적인 이온화 경향과 전해질의 농도에 따라 달라진다. 따라서 25°C, 1기압에서 반쪽 전지의 수용액의 농도가 1M일 때, 표준 수소 전극을 (-)극으로 하여 얻은 반쪽 전지의 전위를 표준 전극 전위(standard electrode potential)라고 한다.
표준 환원 전위 편집
반쪽 반응이 환원 반응일 때의 표준 전극 전위를 표준 환원 전위(standard reduction potential)라고 하며, E°로 나타낸다. 일반적으로 전극 전위는 표준 환원 전위 값으로 주어지며 표준 환원 전위 값이(+)이면 수소보다 환원되기 쉽고, (-)이면 수소보다 환원되기 어렵다는 것을 의미한다. 반쪽 반응이 산화 반응일 때의 표준 전극 전위를 표준 산화 전위(standard oxidation potential)라고 하며, 표준 산화 전위는 표준 환원 전위와 크기는 같지만 부호가 반대이다.
표준 산화 전위 = -표준 환원 전위
표준 환원 전위 표 편집
| 전극 반응(반쪽 반응) | E°(V) |
|---|---|
| -3.05 | |
| -2.92 | |
| -2.97 | |
| -2.71 | |
| -2.34 | |
| -1.66 | |
| -0.83 | |
| -0.76 | |
| -0.45 | |
| -0.40 | |
| -0.26 | |
| -0.14 |
표준 전지 전위의 계산 편집
두 반쪽 전지의 전극 전위 값의 차는 전지 전위에 해당한다. 따라서 전지를 구성하는 두 반쪽 전지의 표준 전극 전위 값알면 다음과 같이 표준 전지 전위를 계산할 수 있다.
표준 전지 전위 = (+)극의 표준 환원 전위 - (-)극의 표준 환원 전위 = (+)극의 표준 환원 전위 + (-)극의 표준 산화 전위
표준 전지 전위 와 의 비교 편집
- 이어서 인 경우에는 반응이 자발적으로 일어난다.
- 이어서 인 경우에는 반응이 자발적으로 일어나지 않는다.(역반응이 자발적으로 일어난다.)
여러 가지 전지 편집
이 문단은 위키백과의 편집 지침에 맞춰 다듬어야 합니다. (2020년 4월 15일) |
- (1) 충전과 방전
화학 전지는 일정 시간 동안 사용하면 전지 전위가 떨어지게 되는데, 이때 외부에서 전원을 공급하면 전지가 재생될 수도 있다. 이와 같이 사용한 전지에 전류를 흘려 주어 전지가 재생되는 과정을 충전(charge)이라 하고, 전지를 사용하여 전지가 소모되는 과정을 방전(discharge)이라고 한다.
- (2) 1차 전지와 2차 전지
외부에서 전류를 흘려 주어도 재생되지 않는 전지를 비가역 전지 또는 1차 전지라고 하며, 볼타 전지나 건전지 등이 이에 속한다. 충전과 방전 모두 가능한 전지를 가역 전지 또는 2차 전지라고 하며, 다니엘 전지, 납 축전지, 리튬 이온 전지, 니켈 카드뮴 전지 등이 이에 속한다.
1차전지(아연-탄소 건전지) 편집
① 망가니즈 건전지(아연-탄소 건전지) 건전지라고 하면 보통 망가니즈 건전지를 의미하며, 우리나라에서 가장 많이 사용되는 1차 전지이다. (-)극은 아연 금속, (+)극은 탄소 막대, 전해질 수용액은 염화 암모늄(NH4Cl)의 포화 수용액과 ZnCl2의 반죽을 사용하며, 전지의 전지 전위는 1.5V 정도이다. 건전지는 완전히 건조한 것은 아니지만 전해질이 액체가 아닌 반죽이라는 것으로부터 건전지라는 이름이 유래하였다.
1) 전극 반응 : 아연-탄소 건전지를 회로에 연결하면 (-)극에서는 아연이 산화되고, (+)극인 탄소 막대에서는 수소 이온이 환원되는 반응이 일어난다.
(-)극 : Zn(s) → Zn2+(aq) + 2e- (산화)
(+)극 : 2NH4+(aq) + 2MnO2(s) + 2e- → Mn2O3(s) + H2O(l) + 2NH3(aq) (환원)
2) 특징 : 아연-탄소 건전지는 수소 기체가 발생하지 않는데, 이것은 감극제인 MnO2의 산화 작용으로 수소 기체가 물로 변하기 때문이다.
3) 이용 : 휴대용 라디오, 손전등, 녹음기 등에 많이 사용되고 있다.
② 알칼리 건전지 아연-탄소 건전지의 산성 전해질을 알칼리 전해질인 수산화칼륨(KOH)으로 바꾼 것이다.
1) 전극 반응 : 염기성 조건이므로 산화 반응의 결과 산화 아연(ZnO)이 생성된다.
(-)극 : Zn(s) + 2)H-(aq) → ZnO(s) + H2O(l) + 2e- (산화)
(+)극 : 2MnO2(s) + H2O(l) + 2e- → Mn2O3(s) + 2OH-(aq) (환원)
2) 특징 : 알칼리 건전지는 전해질로 KOH 등의 알칼리 전해질을 사용하기 때문에 사용하지 않을 때에는 아연이 부식되지 않아 전지의 수명이 길어지며, 염기성 용액에서는 이온의 이동이 보다 효율적이므로 아연-탄소 건전지에 비해 보다 안정한 전류와 전압, 강한 전력을 얻을 수 있다.
③ 수은 전지
1) 전극 반응 : (-)극은 아연(Zn)이고, (+)극은 산화 수은(HgO)과 접촉해 있는 강철이며, 전해질로는 KOH 수용액을 사용한다.
(-)극 : Zn(s) + 2OH-(aq) → ZnO(s) + H2O(l) + 2e- (산화)
(+)극 : HgO(s) + H2O(l) + 2e- → Hg(l) + 2OH-(aq) (환원)
2) 특징 : 수은 전지는 오랜 시간 동안 일정한 전압(1.3V)을 공급해 준다.
3) 이용 : 수은 전지는 손목 시계, 심장 박동 보조기 등에 사용되며 수은은 독성이 있어 환경 오염의 원인이 되므로 사용이 줄어들고 있다.
④ 산화 은 전지
1) 전극 반응 : 산화 은 전지에서 (-)극은 금속 아연(Zn)이고, (+)극은 산화 은(Ag22O)이며, 전해질은 KOH이다.
(-)극 : Zn(s) + 2OH-(aq) → ZnO(s) + H2O(l) + 2e- (산화)
(+)극 : Ag2O(s) + H2O(l) + 2e- → 2Ag(s) + 2OH- (환원)
2) 특징 : 산화 은 전지는 은을 포함하기 때문에 비싸지만, 수은 전지보다 전압(1.5V)이 크다는 장점이 있다.
3) 이용 : 산화 은 전지는 손목 시계, 계산기, 자동 노출 카메라 등에 사용된다.
2차전지(납축전지) 편집
① 납축전지 납(Pb)과 이산화납(PbO2)을 묽은 황산에 담근 전지로, 납축전지 1개의 전지 전위는 2V 정도이다. 자동차의 배터리에 이용되는 축전지의 전지 전위는 12V 정도인데, 이것은 납축전지 6개를 직렬로 연결하여 구성되기 때문이다.
1) 전극 반응 : (-)극인 Pb판과, (+)극인 PbO2판에서 일어나는 반응은 다음과 같다.
(-)극�: Pb(s) + SO42-(aq) -> PbSO4(s) + 2e- (산화)
(+)극�: PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- -> PbSO4(s) + 2H2O(l) (환원)
전체 반응�: Pb(s) + PbO2(s) + 2H2SO4(aq) -> 2PbSO4(s) + 2H2O(l)
2) 특징�: 납축전지는 충전이 가능한 2차 전지이지만 크기가 너무 크고 무겁다는 단점이 있다. 납축전지를 사용하면 두 전극의 질량은 점점 증가하고, 전해액의 비중은 감소한다. 따라서
황산 용액의 비중을 조사하면 납축전지의 방전 정도를 알아낼 수 있다.
② 니켈-카드뮴 전지
1) 전극 반응 : (-)극은 금속 카드뮴(Cd)이고, (+)극은 금속 니켈을 지지체로 하는 산화니켈(NiO2)이며, 전해질로는 KOH 수용액을 사용한다.
(-)극 : Cd(s) + 2OH-(aq) -> Cd(OH)2(s) + 2e- (산화)
(+)극 : NiO2(s) + 2H2O(l) +2e- -> Ni(OH)2(s) + 2OH-(aq) (환원)
2) 특징 : 니켈-카드뮴 전지는 재충전해서 다시 사용할 수 있는 2차 전지로, 소형이므로 휴대하기가 간편하지만 납축전지에 비해 값이 비싼 단점이 있다.
3) 이용 : 니켈-카드뮴 전지는 계산기나 전기 면도기, 전기 공구, 카메라의 플래시, 휴대용 카세트 등에 이용되고 있다.
③ 리튬-이온 전지
1) 구조와 원리 : 현재 리튬-이온 전지에 이용하는 (-)극은 LiCoO2이고, (+)극은 흑연이다. 충전 시에는 LiCoO2 속에 있는 리튬 이온이 빠져나와서 (+)극의 결정 속으로
들어가고, 방전 시에는 역반응이 일어나 흑연 격자 구조 속에 있던 리튬 이온이 빠져나와 전해질 속을 이동하여 (-)극의 결정 구조 속으로 들어간다. 즉, 충전과 방전 시에
리튬 이온이 (+)극과 (-)극 사이를 왔다갔다하게 된다.
2) 특징 : 리튬-이온 전지는 다른 2차 전지에 비해 에너지 밀도가 매우 높고, 작동 전압이 3.6V 정도로 기존 전지의 3배나 된다.
·리튬-이온 전이의 전해질로는 수용액 대신 유기 용매를 사용한다. 그 이유는 전지 내부의 전해질에서 산화·환원 반응이 일어날 때, 전해액이 수용액일 경우 1.35V에서 전기 분해가
일어나기 때문이다. 따라서 4V 이상의 전위차에서도 전기 분해가 되지 않는 안정한 유기 용매를 전해질로 사용한다.
·리튬-이온 전지는 전해액을 사용하기 때문에 전해액을 담는 용기가 필요하여 전지의 소형화에 한계가 있으며, 고온에서 전해액으로 사용되는 유기 용매가 폭발할 위험성이 있다.
이러한 단점을 극복한 리튬-폴리머 전지는 원리가 리튬-이온 전지와 같지만 전해액을 사용하지 않기 때문에 리튬-이온 전지보다 안정하다는 장점이 있다.
·리튬-이온 전지에는 순수한 리튬 금속은 포함되어 있지 않다. 리튬은 반응성이 매우 높은 금속이며, 물에 닿으면 폭발적인 반응을 일으켜 위험할 수 있다.
2) 이용 : 리튬-이온 전지는 휴대폰, 노트북, 카메라, 심장 박동기 등에 이용된다.
연료전지(수소전지) 편집
연료가 연속적으로 산화되는 반응으로부터 전기 에너지를 얻는 전지를 연료 전지(fuel cell)라고 하며, 대표적 연료 전지 수소-산소 연료 전지가 있다.
1) 수소-산소 연료 전지 : 전극으로는 금속 촉매를 주입한 다공성의 탄소 전극을 사용하고, (-)극에는 수소 기체를, (+)극에는 산소 기체를 공급해 주며, 전해질로는 KOH 수용액을 사용한다.
(-)극�: 2H2(g) + 4OH-(aq) -> 4H2O(l) + 4e- (산화)
(+)극�: O2(g) + 2H2O(l) + 4e- -> 4OH- (환원)
전체 반응�: 2H2(g) + O2(g) -> 2H2O (l)
2) 연료 전지의 특징�: ·연료 전지는 반응 생성물이 물이므로 환경오염 물질을 배출하지 않는다는 장점이 있어 1960년대에 우주 왕복선의 동력원으로 쓰인 후 최근에는 여러 분야에서 이용되고
있다. 그러나 장치가 너무 크고 값이 비싸다는 단점이 극복해야 할 과제이다.
·일반 전지와는 달리 연료 전지는 재충전할 필요가 없으며, 연료가 공급되는 한 계속해서 전기를 만들어 낼 수 있다. 즉, 수소를 (-)극에 공급하고 산소를 (+)극에 공급
하여 연속적으로 전기 에너지를 생산할 수 있다.
·연료가 전기 화학적으로 반응하여 전기를 생산하는 과정에서 에너지의 손실이 매우 작으므로 70~80% 정도의 고효율 발전이 가능하다.
·소음이 매우 적으며, 공해 물질의 배출이 거의 없는 무공해 에너지 기술이다.
·도심 지역 또는 건물 내 설치가 가능하여 경제적으로 에너지를 공급할 수 있으며, 천연가스, 도시가스, 나프타, 메탄올, 폐기물 가스 등 다양한 연료를 사용할 수 있으
므로 기존의 화력 발전을 대체하고, 분산 전원용 발전소, 열병합 발전소, 무공해 자동차 전원 등에 이용될 수 있다.
같이 보기 편집
각주 편집
- ↑ “Electrolytic Cells”. 《hyperphysics.phy-astr.gsu.edu》. 2018년 5월 17일에 확인함.
- ↑ “Electrochemical Cells”. 《hyperphysics.phy-astr.gsu.edu》. 2018년 5월 17일에 확인함.
Electrochemical cells which generate an electric current are called voltaic cells or galvanic cells, and common batteries consist of one or more such cells. In other electrochemical cells an externally supplied electric current is used to drive a chemical reaction which would not occur spontaneously. Such cells are called electrolytic cells.
- ↑ “Byjus ( a tutorial site)”.