신경근 접합부
신경근 접합부(neuromuscular junction, NMJ; myoneural junction)는 운동 신경 세포와 근섬유 사이의 화학적 시냅스이다.[1]
| 신경근 접합부 | |
|---|---|
 | |
 신경근 접합부의 모식도.
| |
| 정보 | |
| 식별자 | |
| 라틴어 | synapssis neuromuscularis junctio neuromuscularis |
| 영어 | neuromuscular junction |
| MeSH | D009469 |
| TH | H2.00.06.1.02001 |
| FMA | 61803 |
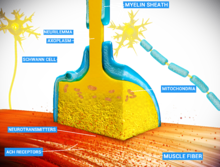

운동 신경 세포는 신경근 접합부를 통해 근섬유에 신호를 전달하여 근수축을 일으킨다.
근육이 기능하기 위해서는 신경의 지배가 필요하며, 근긴장도를 유지하고 근육의 위축을 막기 위해서도 신경이 필수적이다. 신경근육계(neuromuscluar system)에서는 중추신경계와 말초신경계의 신경이 연결되어 근육과 함께 작용한다.[2] 신경근 접합부에서 시냅스 전달은 활동전위가 운동 신경 세포의 시냅스 전 신경 세포의 말단에 도달할 때 시작되며, 이는 전압 개폐 칼슘 통로를 활성화하여 칼슘 이온이 신경 세포 안으로 들어갈 수 있도록 한다. 칼슘 이온은 시냅스 소포의 센서 단백질인 시냅토태그민에 결합하여 세포막과 소포가 융합되도록 하고, 그 결과 운동 신경 세포에서 시냅스 틈으로 신경전달물질이 방출된다. 척추동물에서 운동 신경 세포는 소분자 신경전달물질인 아세틸콜린(ACh)을 방출하는데, 아세틸콜린은 시냅스 틈을 가로질러 확산되고 근섬유의 세포막(근초, sarcolemma)에 있는 니코틴성 아세틸콜린 수용체(nAchR)에 결합한다. nAChR은 이온 통로로서, 특정 리간드에 의해 열리고 닫히는 리간드 개폐 통로이기도 하다. ACh가 수용체에 결합하면 근육 섬유를 탈분극시켜 연쇄 반응을 일으키며, 최종적으로는 근육 수축을 유발한다.
신경근 접합부 질환은 유전이나 자가면역으로 인해 발생할 수 있다. 선천성 근무력증과 같은 유전 질환은 신경근 접합부를 구성하는 구조 단백질에 돌연변이가 일어나 발생할 수 있는 반면, 중증 근무력증과 같은 자가 면역 질환은 근초의 니코틴성 아세틸콜린 수용체에 대한 자가항체가 만들어져 발생한다.
구조 및 기능 편집
전송 편집
신경근 접합부에서 시냅스 전 운동 신경 세포의 축삭은 근육 섬유의 세포막(근초)에서 30nm로 떨어진 지점에서 끝난다. 신경근 접합부에 있는 근초에는 접합 후 접힘(postjunctional folds)이라고 하는 함입된 부분이 있으며, 이 부분은 시냅스 틈을 향한 근초의 표면적을 증가시킨다.[3] 이러한 접합 후 접힘은 10,000개/μm2 정도의 밀도로 니코틴성 아세틸콜린 수용체(nAChR)가 박혀 있는 운동 종말판(motor end plate)을 형성한다.[4] 시냅스 이전 축삭은 근초의 접합 후 접힘을 향해 튀어나와 있는 돌출부(teminal boutons)에서 끝난다. 개구리의 각 운동 신경 세포 말단에는 평균 직경이 0.05마이크로미터인 약 300,000개의 소포가 존재한다. 소포에는 아세틸콜린이 들어 있다. 이 소포 중 일부는 50개씩 그룹으로 모여서 신경막에 가까운 활성 영역(active zones)에 위치한다. 활성 영역은 약 1마이크로미터 떨어져 있다. 신경 말단과 운동 종말판 사이의 30nm 정도 떨어진 시냅스 틈에는 2,600 효소 분자/μm2 밀도의 아세틸콜린에스터레이스(AChE)로 이루어진 망(meshwork)이 포함되어 있으며 구조 단백질인 디스트로핀과 랩신에 의해 고정되어 있다. 또한 수용체 타이로신 인산화효소 단백질의 일종인 MuSK 단백질이 존재하는데, 이는 신경근 접합부의 발달에 관여하는 신호 전달 단백질이다. MuSK도 랩신에 의해 고정되어 있다.[3]
SNARE 단백질에 의해 매개되는 과정에서, 시냅스 소포 중 하나가 무작위로 휴지 상태의 신경근 접합부에서 시냅스 전 신경 세포의 세포막과 융합한다. 소포가 융합되면 소포에 담겨 있던 아세틸콜린 7000-10,000분자가 시냅스 틈으로 방출되며, 이 과정을 세포외 배출이라고 한다.[5] 운동 종말판에 도달하는 아세틸콜린은 최대 2,000개의 아세틸콜린 수용체를 활성화하고, 이온 통로를 열어 나트륨 이온이 종말판으로 이동할 수 있도록 하여 MEPP(miniature endplate potential)로 알려진 ~0.5mV의 탈분극 상태를 형성한다. 아세틸콜린이 수용체에서 방출될 때까지 아세틸콜린에스터레이스는 약 0.16ms 동안 수용체에 결합된 ACh를 파괴한다.
운동 신경 세포가 자극되면 운동 신경 세포 말단에 신경 자극이 도달한 후 운동 종말판의 첫 번째 반응 사이에 0.5~0.8밀리초의 짧은 지연이 있다.[6] 운동 신경의 활동전위가 시냅스 전 신경 세포 말단에 도달하면 전압 개폐 칼슘 통로가 열려 Ca2+ 이온이 세포외액에서 시냅스 전 신경 세포의 세포질로 들어온다. Ca2+가 유입되면 신경전달물질이 들어 있는 수백 개의 소포가 SNARE 단백질을 통해 시냅스 이전 신경 세포의 세포막과 융합하여 세포외 배출에 의해 아세틸콜린을 방출하도록 한다. 방출된 아세틸콜린에 의해 형성되는 운동 종말판 탈분극을 종말판 전위(enplate potentail, EPP)라고 한다. EPP는 ACh가 운동 종말판에서 니코틴성 아세틸콜린 수용체(nAChR)에 결합하여 나트륨 이온의 유입을 일으킬 때 발생한다. 나트륨 이온이 유입되면 EPP(탈분극)가 형성되고, EPP에 의한 활동전위는 근초를 따라 이동하여 가로세관(T세관)의 전압 개폐 나트륨 통로를 통해 근육 섬유로 이동한다.[7] 가로세관을 따라 활동전위가 전도되면 근소포체의 Ca 2+ 방출 통로에 기계적으로 연결된 전압 개폐 칼슘 통로를 자극하여 열리게 한다.[8] 그런 다음 Ca 2+는 근소포체에서 근육 원섬유로 확산되어 근수축을 자극할 수 있다. 따라서 종말판 전위는 근섬유에서 근수축을 유발하는 활동전위를 설정하는 역할을 한다. 신경에서 근육으로의 아세틸콜린 전달은 아세틸콜린이 밀리몰 단위의 농도로 종말판에 도달하기 때문에 매우 빠르다. 밀리몰 수준의 농도는 친화도가 낮은 아세틸콜린 수용체와 결합할 수 있을 만큼 충분히 높으며, 이후 수용체는 결합된 신경전달물질을 다시 신속하게 방출한다.
아세틸콜린 수용체 편집
아세틸콜린은 식이 콜린과 아세틸-CoA(ACoA)에서 합성되는 신경전달물질로, 척추동물과 일부 무척추동물의 근육 조직 자극에 관여한다. 척추동물의 골격근의 신경근 접합부에서 발견되는 아세틸콜린 수용체 아형은 리간드 개폐 통로인 니코틴성 아세틸콜린 수용체(nAChR)이다. 이 수용체의 각 소단위는 두 시스테인 잔기와 그 사이의 잘 보존된 13개의 아미노산 잔기로 구성된 특징적인 고리 모양 구조인 '시스 루프'(cys-loop)를 가지고 있다. 2개의 시스테인 잔기는 이황 결합을 형성하여 아세틸콜린 및 기타 리간드에 결합할 수 있는 시스 루프 수용체를 형성하며, 니코틴성 아세틸콜린 수용체도 이 시스 루프 수용체에 속한다. 이 시스 루프 수용체는 진핵생물에서만 발견되지만, 원핵생물은 유사한 특성을 가진 ACh 수용체를 가지고 있다.[4] 모든 종이 콜린성 신경근 접합부를 사용하는 것은 아니다. 예를 들어 가재와 초파리에는 글루탐산성 신경근 접합부가 있다.[3]
골격근 신경근 접합부의 AChR은 2개의 α, 1개의 β, 1개의 ɛ, 1개의 δ 소단위로 구성된 이종오합체(heteropentamer)를 형성한다.[9] 하나의 ACh 리간드가 ACh 수용체의 α 소단위 중 하나에 결합하면 두 번째 AChR α 소단위와의 경계면의 형태 변화를 유도한다. 이러한 형태 변화는 두 번째 ACh 리간드에 대한 두 번째 α 소단위의 친화도를 증가시킨다. AChR은 이런 협동결합으로 인해 S자형 해리 곡선을 나타낸다.[4] 단일 결합 리간드가 있는 비활성 중간 수용체 구조는 콜린에스터레이스에 의한 가수분해나 확산에 의해 손실될 수 있는 ACh를 시냅스에서 유지한다. 이런 방식으로 시냅스에서 ACh 리간드가 계속 존재하면 시냅스 후 반응이 연장될 수 있다.[10]
발달 편집
신경근 접합부의 발달은 운동 신경 세포의 말단과 근육 세포의 중심 영역 양쪽 모두로부터의 신호 전달을 필요로 한다. 근육 세포는 발달하는 동안 아세틸콜린 수용체(AChR)를 생성하고 프리패터닝(prepatterning)이라는 과정을 통해 AChR을 중앙 영역에서 발현한다. 헤파린 프로테오글리칸인 아그린과 MuSK 인산화효소는 근세포의 중앙 영역에서 AChR가 축적되는 것을 안정화하는 데 도움이 되는 것으로 생각된다. MuSK는 수용체 타이로신 인산화효소로, 타이로신과 같은 자체 영역이나 세포질의 다른 표적에 인산염 분자를 결합하여 세포 신호를 유도한다.[11] 아그린을 리간드로 해서 활성화되면 MuSK는 Dok-7과 랩신이라는 두 단백질을 통해 신호를 보내 아세틸콜린 수용체의 군집화(clustering)를 유도한다.[12] 발달 중인 운동 신경 세포가 방출한 ACh는 근육 세포에서 발달 중인 신경근 접합부의 국소화(localization), 안정화(stabilization)를 강화하는 시냅스 후 전위를 생성한다.[13]
이러한 발견은 전이유전자를 통한 녹아웃 마우스 연구에 의해 부분적으로 입증되었다. 아그린이나 MuSK가 결핍된 마우스에서는 신경근 접합부가 형성되지 않았다. 또한, Dok-7이 결핍된 마우스는 아세틸콜린 수용체 군집이나 신경근 시냅스를 형성하지 않았다.[14]
신경근 접합부의 발달은 주로 설치류와 같은 모델 유기체를 통해 연구된다. 또한 2015년에는 인간 배아줄기세포와 몸근육줄기세포를 이용해 시험관 내에서 완전한 인간 신경근 접합부를 만들어 냈다.[15] 이 모델에서 시냅스 전 운동 신경 세포는 광유전학적인 기전에 의해 활성화되고 그에 대한 반응으로 시냅스로 연결된 근육 섬유는 빛 자극에 경련한다.
연구 방법 편집
José del Castillo와 Bernard Katz는 신경근 접합부에서 nAChR의 위치와 밀도를 결정하기 위해 이온 영동법(ionophoresis)을 사용했다. 이 기술에서는 근섬유의 운동 종말판 내부에 미세전극을 배치하고 아세틸콜린(ACh)으로 채워진 마이크로피펫을 시냅스 틈의 종말판 바로 앞에 배치한다. 양전하를 띤 ACh 분자가 피펫에서 방출되도록 하는 마이크로피펫의 끝에 양의 전압이 가해졌다. ACh 분자는 시냅스 틈을 나타내는 공간으로 흘러 AChR에 결합했다. 세포 내 미세전극은 니코틴성(이온성) 아세틸콜린 수용체에 ACh가 결합한 것에 대한 반응으로 나타나는 운동 종말판의 탈분극의 진폭을 모니터링했다. Katz와 del Castillo는 탈분극의 진폭(흥분성 연접후 전위)이 ACh 이온을 종말판으로 방출하는 마이크로피펙이 얼마나 가까이 있는지에 의존적이라는 것을 보였다. 즉, 마이크로피펫이 운동 종말판에서 멀수록 근육 섬유에서 발생하는 탈분극이 작아졌다. 이를 통해 연구자들은 nAChR이 고밀도로 운동 종말판에 모여 있다고 결론 내릴 수 있었다.[3][4]
독소는 신경근 접합부에서 아세틸콜린 수용체의 위치를 결정하는 데 사용된다. 알파 분가로톡신은 우산뱀(Bungarus multicinctus)에서 발견되는 독소로 AChR에 비가역적으로 결합하여 ACh 길항제 역할을 한다. 겨자무과산화효소(HRP) 같은 분석 가능한 효소나 녹색 형광 단백질(GFP)과 같은 형광 단백질을 알파 분가로톡신에 결합시켜 AChR을 시각화하고 정량화할 수 있다.[3]
신경근 접합부에 영향을 미치는 독소 편집
신경 가스 편집
보툴리눔 독소 편집
보툴리눔 독소(상품명 보톡스로 판매됨)는 SNARE 단백질을 방해하여 신경근 접합부에서 아세틸콜린이 방출되는 것을 억제한다.[3] 이 독소는 세포내이입 과정을 통해 신경 말단을 가로질러 ACh 방출에 필요한 SNARE 단백질을 방해하고, 결국 영향을 받은 가로무늬근에 국한된 일시적인 이완성 마비와 화학적 신경 제거를 유발한다. ACh 방출 억제 효과는 주사 후 평균 일주일 정도 만에 시작된다.[16] 억제가 발생한 지 3개월이 지나면 신경 세포의 기능이 부분적으로 회복되기 시작하고 6개월이 지나면 완전히 뉴런의 기능이 회복된다.[17]
파상풍 독소 편집
파상풍 독소(테타노스파스민)는 파상풍균(Clostridium tetani)에 의해 생성되는 강력한 신경독이며 파상풍을 유발한다. 이 독소의 LD 50 은 대략 1ng/kg로 측정되었고, 이는 세계에서 가장 치명적인 독소인 보툴리눔 독소 D에 이어 두 번째이다. 파상풍 독소는 시냅스 전 신경 말단에 부착되어 세포내이입되고, SNARE 단백질 복합체를 방해하는 방식으로 보툴리눔 독소와 매우 유사하게 기능한다. 그러나 몇 가지 면에서 보툴리눔 독소와 차이가 있으며 가장 명백하게는 최종 상태에서 다르다. 테타노스파스민은 보툴리눔 독소가 이완성 마비를 일으키는 것과 반대로 경직성 마비를 일으킨다.
라트로톡신 편집
과부거미의 독에서 발견되는 라트로톡신(α-라트로톡신)은 시냅스 전 세포에서 아세틸콜린의 방출을 유발하여 신경근 접합부에 영향을 미친다. 라트로톡신의 작용 기전은 인지질분해효소 C가 매개하는 IP3/DAG 경로를 활성화하는 시냅스 전 세포의 수용체에 결합하는 방식과, 세포 내의 저장 공간에서 칼슘 이온이 방출되게 하면서 구멍을 형성하여 칼슘이 직접 유입되게 하는 과정을 포함한다. 두 메커니즘 모두 시냅스 전 세포에서 칼슘을 증가시켜 아세틸콜린이 들어 있는 시냅스 소포를 방출한다. 라트로톡신은 통증, 근육 수축을 유발하며 치료하지 않으면 잠재적으로 마비나 사망에 이르게 할 수 있다.
뱀의 독 편집
뱀의 독은 신경근 접합부에서 독소로 작용하여 쇠약과 마비를 유발할 수 있다. 독은 시냅스 전과 시냅스 후에서 모두 신경독으로 작용할 수 있다.[18]
일반적으로 β-신경독으로 알려진 시냅스 전 신경독은 신경근 접합부의 시냅스 전 영역에 영향을 미친다. 이러한 신경독의 대부분은 아세틸콜린과 같은 신경 전달 물질이 신경 세포 사이의 시냅스로 방출되는 것을 억제하는 방식으로 작용한다. 그러나 이러한 독소 중 일부는 신경전달물질 방출을 오히려 향상시키는 것으로 알려져 있다. 신경전달물질 방출을 억제하는 것은 신호 분자가 시냅스 후 표적 수용체에 도달하는 것을 방지하는 신경근 차단제와 같은 효과를 낸다. 따라서 뱀에게 물린 희생자는 심각한 근육의 쇠약을 겪게 된다. 이러한 신경독은 해독제에 잘 반응하지 않는다. 노텍신이나 타이폭신과 같은 이러한 독소가 들어온 지 1시간이 지나면 영향을 받은 많은 신경 말단이 돌이킬 수 없는 물리적 손상의 징후를 보이며, 신경전달물질을 전달하는 시냅스 소포가 없어진다.[18]
α-신경독으로 알려진 시냅스 후 신경독은 시냅스 후 아세틸콜린 수용체에 결합하여 시냅스 전 신경독과 반대로 작용한다. 구체적으로는 시냅스 전 신경 세포 말단에서 방출되는 아세틸콜린과 시냅스 후 세포의 수용체 사이의 상호작용을 방지한다. 아세틸콜린 수용체와 관련된 나트륨 통로가 열리지 않게 되어 시냅스 전 신경독으로 인해 나타나는 효과와 유사한 신경근 차단 효과를 낸다. 이후 영향을 받은 신경근 접합부와 관련된 근육에 마비를 일으킨다. 시냅스 전 신경독과 달리 시냅스 후 신경독은 해독제에 의해 비교적 쉽게 회복되는데, 해독제는 수용체에서 독소가 더 빠르게 해리되도록 하여 궁극적으로 마비를 역전시킨다. 이러한 신경독은 아세틸콜린 수용체 밀도 및 회전율 연구뿐만 아니라, 중증 근무력증 환자에서 질병의 영향을 받은 아세틸콜린 수용체에 대한 항체의 방향을 관찰하는 연구에서 도움을 준다.[18]
질병 편집
운동 신경 세포와 근육 세포 사이의 시냅스 전달을 손상시키는 모든 질병은 신경근육질환이라는 포괄적인 용어로 분류된다. 이러한 장애는 유전되거나 후천적으로 생길 수 있으며 심각도와 사망률이 각기 다르다. 일반적으로 이러한 장애의 대부분은 돌연변이나 자가 면역으로 인해 발생하는 경향이 있다. 자가 면역 장애의 경우에는 체액 면역과 B세포에 의해 매개되는 경향이 있으며, 이 경우 시냅스 전달 또는 신호 전달에 관여하는 운동 신경 세포나 근섬유의 단백질에 대해 부적절한 항체가 만들어진다.
자가 면역 편집
중증 근무력증 편집
중증 근무력증은 신체가 아세틸콜린 수용체(AchR, 80%의 사례에서 나타남) 또는 시냅스 후 근육 특이적 인산화효소(MuSK 단백질, 0-10%의 사례에서 나타남)에 대한 항체를 만드는 자가 면역 질환이다. 혈청음성 중증 근무력증에서 저밀도 지단백질 수용체 관련 단백질 4는 리간드의 경쟁적 억제제로 작용하여 리간드가 수용체에 결합하는 것을 방지하는 IgG1의 표적이 된다. 혈청음성 중증 근무력증이 표준 요법에 반응하는지 여부는 알려져 있지 않다.[19]
신생아 중증 근무력증 편집
신생아 중증 근무력증(neonatal MG)는 중증 근무력증 진단을 받은 산모에게서 태어난 어린이 8명 중 1명에게 영향을 미치는 자가 면역 질환이다. 태반을 통해 AChR 항체가 산모에서 태아로 이동하며 중증 근무력증이 옮겨질 수 있다. 출생 시 이 질병의 징후에는 콜린에스터레이스 억제제 약물에 반응하는 쇠약이나, 태아 운동 장애, 움직임 부족 등이 있다. 이 형태의 질병은 일시적이며 약 3개월 동안 지속된다. 그러나 어떤 경우에는 신생아 중증 근무력증이 관절염이나, 심지어 태아 사망과 같은 다른 건강의 악영향을 유발할 수 있다. 이러한 상태는 모체 AChR 항체가 태아 AChR로 향할 때 시작되는 것으로 여겨지며 AChR의 γ 소단위가 ε 소단위로 대체되는 임신 33주까지 지속될 수 있다.[20][21]
람베르트-이튼 근무력 증후군 편집
람베르트-이튼 근무력 증후군(LEMS)은 신경근 접합부의 시냅스 전 부분에 영향을 미치는 자가 면역 질환이다. 이 희귀 질환은 몸쪽 근육 약화, 자율신경계이상, 무반사와 같은 독특한 3가지 증상이 특징적이다.[22] 몸쪽 근육 약화는 P/Q형 전압 개폐 칼슘 통로에 대한 병원성의 자가항체로 인한 결과이며, 이는 차례로 시냅스 전 세포의 운동 신경 말단에서 아세틸콜린 방출을 감소시킨다. LEMS로 인한 자율신경계 기능 장애의 예로는 남성의 발기부전, 변비, 가장 일반적으로 구강건조증 등이 있다. 덜 흔한 기능 장애로는 안구 건조와 땀 분비 변화가 있다. 무반사는 힘줄 반사가 감소하는 상태이며 운동 후에는 증상이 일시적으로 가라앉을 수 있다.[23]
LEMS로 진단된 환자의 50-60%는 관련하여 종양도 보이는데, 가장 일반적으로는 소세포폐암(SCLC)이 나타난다. 이 유형의 종양은 전압 개폐 칼슘 통로를 나타낸다.[23] 종종 LEMS는 중증 근무력증과 함께 발생한다.[22]
LEMS에 대한 치료 시에는 3,4-디아미노피리딘을 첫 번째로 사용하며, 3,4-디아미노피리딘은 전압 개폐 칼륨 통로를 차단한 후 전압 개폐 칼슘 통로가 열린 상태로 유지되는 시간을 연장하여 근육의 활동전위와 근력을 증가시키는 역할을 한다. 미국에서는 자격이 있는 LEMS 환자에 대한 3,4-디아미노피리딘 치료가 확장 액세스 프로그램에 따라 무료로 제공된다.[24][25] 3,4-디아미노피리딘이 치료에 도움이 되지 않는 경우 추가 치료를 시행하며, 추가 치료에는 프레드니손과 아자티오프린 등을 사용한다.[23]
신경근긴장증 편집
아이작 증후군으로도 알려진 신경근긴장증(NMT)은 신경근 접합부에 걸리는 다른 많은 질병과 다르다. NMT는 근육 약화가 아니라, 운동 신경의 과흥분을 유발한다. NMT는 전압 개폐 칼륨 통로를 하향 조절하여 더 긴 탈분극을 생성하고 과흥분 상태에 빠뜨린다. 이로 인해 신경전달물질 방출이 늘어나고 반복적인 신경 발사가 일어난다. 이러한 발사 속도의 증가는 보다 적극적인 신호 전달을 유도하고, 결과적으로 영향을 받는 사람의 근육 활동을 증가시킨다. NMT는 영향을 받는 사람의 자가 면역 증상과의 연관성이 있어 자가 면역이 원인으로 여겨진다.[20]
유전병 편집
선천성 근무력 증후군 편집
선천성 근무력 증후군(CMS)은 기능(증상) 면에서 중증 근무력증이나 람베르트-이튼 근무력 증후군과 매우 유사하지만, CMS와 이러한 질병들의 큰 차이점은 CMS가 유전적인 원인으로 발생한다는 것이다. CMS는 신경근 접합부의 시냅스 전, 시냅스, 시냅스 후 단백질에 영향을 미치는 적어도 10개의 유전자 중 1개에서 돌연변이(일반적으로 열성)가 생겨 발생하는 질병이다. 이러한 돌연변이는 일반적으로 AChR의 ε 소단위에서 발생하여[20] 수용체 자체의 반응과 발현에 영향을 미친다. 단일 뉴클레오티드 치환, 또는 결실은 소단위의 기능을 상실시킬 수 있다. 아세틸콜린에스터레이스나 아세틸기전이효소에 영향을 미치는 돌연변이 등 다른 돌연변이도 CMS를 유발할 수 있으며, 후자는 특히 간헐성 무호흡증과 관련이 있다.[26] 이러한 증후군은 사람마다 다른 시기에 나타날 수 있다. 태아기에 발생하면 태아의 운동불능증이나, 출생 전후의 관절굽음증, 안검하수, 근긴장저하, 안근마비, 섭식 및 호흡 곤란과 같은 상태가 관찰될 수 있다. 청소년기나 성인기에 발생하면 slow-channel syndrome의 원인이 될 수 있다.[20]
CMS의 특정 아형(postsynaptic fast-channel CMS)[27][28]ㅇ 치료는 다른 신경근 장애에 대한 치료와 유사. LEMS의 1차 치료제인 3,4-Diaminopyridine 은 미국에서 CMS의 희귀의약품으로 개발 중이다[29] .[24][25]
같이 보기 편집
추가 자료 편집
- Kandel, ER; Schwartz JH; Jessell TM. (2000). 《Principles of Neural Science》 4판. New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Nicholls, J.G.; A.R. Martin; B.G. Wallace; P.A. Fuchs (2001). 《From Neuron to Brain》 4판. Sunderland, MA.: Sinauer Associates. ISBN 0-87893-439-1.
- Engel, A.G. (2004). 《Myology》 3판. New York: McGraw Hill Professional. ISBN 0-07-137180-X.
각주 편집
- ↑ Levitan, Irwin; Kaczmarek, Leonard (2015년 8월 19일). 〈Intercellular communication〉. 《The Neuron: Cell and Molecular Biology》 4판. New York, NY: Oxford University Press. 153–328쪽. ISBN 978-0199773893.
- ↑ Rygiel, K (August 2016). “The ageing neuromuscular system and sarcopenia: a mitochondrial perspective.”. 《J. Physiol.》 594 (16): 4499–4512. doi:10.1113/JP271212. PMC 4983621. PMID 26921061.
- ↑ 가 나 다 라 마 바 Nicholls, John G.; A. Robert Martin; Paul A. Fuchs; David A. Brown; Matthew E. Diamond; David A. Weisblat (2012). 《From Neuron to Brain》 5판. Sunderland: Sinauer Associates.
- ↑ 가 나 다 라 Sine SM (July 2012). “End-plate acetylcholine receptor: structure, mechanism, pharmacology, and disease”. 《Physiol. Rev.》 92 (3): 1189–234. doi:10.1152/physrev.00015.2011. PMC 3489064. PMID 22811427.
- ↑ William Van der Kloot; Jordi Molgo (1994). “Quantal acetylcholine release at the vertebrate neuromuscular junction”. 《Physiol. Rev.》 74 (4): 900–991. doi:10.1152/physrev.1994.74.4.899. PMID 7938228.
- ↑ Katz, Bernard (1966). 《Nerve, muscle, and synapse》. New York: McGraw-Hill. 114쪽.
- ↑ McKinley, Michael; O'Loughlin, Valerie; Pennefather-O'Brien, Elizabeth; Harris, Ronald (2015). 《Human Anatomy》. New York: McGraw-Hill Education. 300쪽. ISBN 978-0-07-352573-0.
- ↑ Fox, Stuart (2016). 《Human Physiology》. New York: McGraw-Hill Education. 372쪽. ISBN 978-0-07-783637-5.
- ↑ miller's anaesthesia, 7th edition.
- ↑ “Postsynaptic potentiation and desensitization at the vertebrate end-plate receptors”. 《Prog. Neurobiol.》 38 (1): 19–33. 1992. doi:10.1016/0301-0082(92)90033-B. PMID 1736323.
- ↑ “Receptor tyrosine sinase specific for the skeletal muscle lineage: expression in embryonic muscle, at the neuromuscular junction, and after injury”. 《Neuron》 15 (3): 573–84. 1995. doi:10.1016/0896-6273(95)90146-9. PMID 7546737.
- ↑ “Agrin acts via a MuSK receptor complex”. 《Cell》 85 (4): 513–23. 1996. doi:10.1016/S0092-8674(00)81252-0. PMID 8653787.
- ↑ Witzemann V (November 2006). “Development of the neuromuscular junction”. 《Cell Tissue Res.》 326 (2): 263–71. doi:10.1007/s00441-006-0237-x. PMID 16819627.
- ↑ “The muscle protein Dok-7 is essential for neuromuscular synaptogenesis”. 《Science》 312 (5781): 1802–5. 2006. Bibcode:2006Sci...312.1802O. doi:10.1126/science.1127142. PMID 16794080.
- ↑ Steinbeck, JA; Jaiswal, MK; Calder, EL; Kishinevsky, S; Weishaupt, A; Toyka, KV; Goldstein, PA; Studer, L (2016년 1월 7일). “Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease.”. 《Cell Stem Cell》 18 (1): 134–43. doi:10.1016/j.stem.2015.10.002. PMC 4707991. PMID 26549107.
- ↑ Ledda, Claudia; Artusi, Carlo Alberto; Tribolo, Antonella; Rinaldi, Domiziana; Imbalzano, Gabriele; Lopiano, Leonardo; Zibetti, Maurizio (2022년 2월 3일). “Time to onset and duration of botulinum toxin efficacy in movement disorders”. 《Journal of Neurology》 (영어). doi:10.1007/s00415-022-10995-2. ISSN 1432-1459.
- ↑ “Botulinum toxin in movement disorders”. 《Semin Neurol》 27 (2): 183–94. April 2007. doi:10.1055/s-2007-971171. PMID 17390263.
- ↑ 가 나 다 “Snake venoms and the neuromuscular junction”. 《Semin Neurol》 24 (2): 175–9. June 2004. doi:10.1055/s-2004-830904. PMID 15257514.
- ↑ Finsterer J, Papić L, Auer-Grumbach M (October 2011). “Motor neuron, nerve, and neuromuscular junction disease”. 《Curr. Opin. Neurol.》 24 (5): 469–74. doi:10.1097/WCO.0b013e32834a9448. PMID 21825986.
- ↑ 가 나 다 라 Newsom-Davis J (July 2007). “The emerging diversity of neuromuscular junction disorders”. 《Acta Myol》 26 (1): 5–10. PMC 2949330. PMID 17915563.
- ↑ 〈Neonatal Myasthenia Gravis〉. 《StatPearls》. StatPearls. 2021.
- ↑ 가 나 “Low rate repetitive nerve stimulation in Lambert-Eaton myasthenic syndrome: Peculiar characteristics of decremental pattern from a single-centre experience”. 《Clin Neurophysiol》 124 (4): 825–6. October 2012. doi:10.1016/j.clinph.2012.08.026. PMID 23036181.
- ↑ 가 나 다 “Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies”. 《Lancet Neurol》 10 (12): 1098–107. December 2011. doi:10.1016/S1474-4422(11)70245-9. PMID 22094130.
- ↑ 가 나 [https://web.archive.org/web/20160118144151/http://mda.org/quest/lems-firdapse-study-shows-encouraging-results Archived 2016년 1월 18일 - 웨이백 머신 [1]], Muscular Dystrophy Association Press Release
- ↑ 가 나 [2] 보관됨 2015-07-25 - 웨이백 머신, Rare Disease Report
- ↑ Harper CM (March 2004). “Congenital myasthenic syndromes”. 《Semin Neurol》 24 (1): 111–23. doi:10.1055/s-2004-829592. PMID 15229798.
- ↑ “Congenital myasthenic syndromes: pathogenesis, diagnosis, and treatment.”. 《Lancet Neurol》 14 (4): 420–34. April 2015. doi:10.1016/S1474-4422(14)70201-7. PMC 4520251. PMID 25792100.
- ↑ “New horizons for congenital myasthenic syndromes.”. 《Ann N Y Acad Sci》 1275 (1): 1275:54–62. 2012. Bibcode:2012NYASA1275...54E. doi:10.1111/j.1749-6632.2012.06803.x. PMC 3546605. PMID 23278578.
- ↑ [1], FDA orphan drug designation
외부 링크 편집
- 조직 그림: 21501lca – Histology Learning System - 보스턴 대학교