과립구
과립구(顆粒球, 영어: granulocyte)는 세포질에 과립이 있는 백혈구이다.[1] 과립 백혈구(顆粒白血球), 과립성 백혈구(顆粒性白血球)라고도 한다. 핵 모양이 다양하기 때문에 다형핵백혈구(polymorphonuclear leukocyte, PMN, PML, PMNL)라고도 부른다. 핵은 대개 세 엽으로 나뉘며, 핵이 한 덩어리인 무과립구와 구분된다. 일반적으로 다형핵백혈구라 하면 과립구 중 가장 많은 수를 차지하는 호중성 과립구를 가리킨다.[2] 다른 과립구(호산성 과립구, 호염기성 과립구, 비만 세포)의 수는 적다. 과립구는 골수에서 과립구형성 과정을 통하여 생산된다.
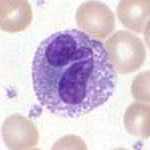
종류 편집
과립구는 라이트 염색으로 관찰할 수 있는 외양에 따라 크게 세 종류가 있다.
각 과립구의 이름은 염색에서 나타나는 특성에서 유래하였다. 예를 들어, 가장 많은 과립구인 호중성 과립구는 세포질에 중성으로 염색되는 과립을 가지고 있다.
호중성 과립구 편집
호중성 과립구 혹은 호중구는 혈류에서 가장 흔하게 발견되는 식세포로, 혈관을 따라 순환하는 백혈구의 50 - 60%를 차지한다.[3] 사람 혈액 1리터에 약 50억 개(5 * 109)의[4] 호중구가 있고, 지름은 12 - 15 μm,[5] 수명은 약 6일이다.[5] 호중구가 적절한 신호를 받으면 30분 이내에 혈관을 떠나 감염이 발생한 곳에 도착한다.[6] 호중구는 혈액으로 돌아가지 않고 고름 세포가 되어 죽는다.[6] 성숙한 호중구는 단핵구보다 작고, 2 - 5개의 분절로 된 핵을 가지고 있다. 각 핵 분절은 염색질 미세섬유로 연결된다. 호중구는 정상적으로 성숙할 때까지 골수를 빠져나가지 않지만, 감염이 있는 경우에 호중구 전구체인 골수세포와 전골수세포(promyelocyte)가 방출된다.[7]
호중구는 세 가지 방법으로 직접 미생물을 공격한다. 미생물을 섭취하는 식세포작용, 수용성 항미생물제(과립 단백질이 포함된다) 방출, 호중구 세포외덫(neutrophil extracellular trap, NET) 생산 등이 그것이다.[8] 호중구는 기본적으로 포식세포이다.[9][10] 체내로 침입하여 항체와 보체로 둘러싸인 대상과 손상된 세포 또는 세포 잔해를 빠르게 먹어치운다. 사람의 호중구에 있는 세포내 과립은 단백질을 분해하고 살균 능력을 가진다.[11] 호중구는 단핵구와 대식세포를 자극하는 물질을 분비한다. 이를 통해 식세포작용이 활발해지고 활성산소종이 생성되어 대상 세포를 파괴한다.[12]
호중구에는 두 종류의 과립이 있다. 어린 세포에 있는 일차 과립은 아주르친화성이고, 더 성숙한 세포에는 특이 과립이 있다. 일차 과립에는 세균을 죽이는데 쓰이는 양이온성 단백질과 디펜신, 세균의 단백질을 분해하기 위한 단백질 가수분해효소와 카텝신 G, 세균의 세포벽을 깨기 위한 라이소자임, 세균을 죽이는 독성 물질을 생산하는 골수세포형과산화효소(myeloperoxidase)가 있다.[13] 일차 과립에서 분비되는 물질은 IgG 항체로 둘러싸인 세균을 잡아먹도록 자극한다.[14] 이차 과립에는 독성이 있는 산소 화합물, 라이소자임, 락토페린(세균에서 필수 철을 얻는 데에 사용하는 물질)을 생산하는 물질이 들어있다.[13] 호중구 세포외덫(NET)은 염색질과 세린 단백질분해효소로 이루어진 섬유망으로 미생물을 세포외에서 잡아 죽인다. 호중구가 병원체에 압도될 때 DNA를 분출하는 현상이다. 최후의 수단이지만, 암세포를 의도치 않게 옮기기 때문에 암을 퍼트릴 수 있다. 패혈증 환자는 세균을 잡는 것이 특히 중요하므로 혈관에 호중구 세포외덫이 형성된다.[15]
호산성 과립구 편집
호산성 과립구 혹은 호산구에는 신장처럼 생긴 엽 2 - 4개로 이루어진 핵이 있다. 호산구가 혈류를 순환하면서 과립을 방출(탈과립)하기 때문에 과립 수는 크게 차이가 난다.[16] 호산구는 기생충(창자에 있는 선충 등)을 죽이는 역할을 한다. 호산구의 과립에는 특이적인 독성 염기성 단백질과 양이온성 단백질(카텝신[13])이 들어 있다.[17] IgE에 결합하는 수용체가 호산구를 돕는다.[18] 호산구는 제한적으로 식세포작용에 참여하고,[19] 보조 T세포, 수지상세포, B세포, 비만 세포, 호중구, 호염기구 등 다른 면역세포 기능을 조절한다.[20] 호산구는 또한 항원제시세포이며, 종양 세포를 파괴하는데 관여하고,[16] 손상된 조직이 복구되도록 촉진한다.[21] 호염기구가 생산하는 인터류킨-5는 호산구와 상호작용하여 호산구가 증식하고 분화하도록 한다.[17]
호염기성 과립구 편집
호염기성 과립구 혹은 호염기구는 골수와 혈액에 가장 적은 세포로 전체 세포 중 2% 미만을 차지한다. 호중구나 호산구와 마찬가지로 호염기구는 엽이 있는 핵을 가지고 있다. 다만 엽이 2개뿐이고 각 엽을 연결하는 염색질이 잘 보이지 않는다. 호염기구는 IgE, IgG, 보체, 히스타민이 결합하는 수용체를 가지고 있다. 호염기구의 세포질에는 다양한 양의 과립이 들어있고, 대개는 부분적으로 핵을 가릴 정도로 많다. 호염기구 과립에는 히스타민, 헤파린, 황산 콘드로이틴, 퍼옥시데이스, 혈소판 활성인자 및 기타 물질이 풍부하다.
감염이 일어나면 성숙한 호염기구는 골수에서 방출되어 감염된 곳으로 이동한다.[22] 호염기구가 손상되면 히스타민을 방출하여 침입한 미생물에 대항하는 염증 반응을 일으킨다. 히스타민은 그 호염기구 근처의 모세혈관을 확장하고 투과성을 높인다. 손상된 호염기구와 기타 백혈구는 프로스타글란딘을 방출하여 감염 부위로 혈액이 많이 이동하게 한다. 이상의 두 기작은 혈액 응고 물질을 감염 부위로 이동시키고 미생물이 몸의 다른 부분으로 이동하지 않도록 막으면서 회복 과정을 시작한다. 염증이 일어난 조직에서 투과성이 증가하면 포식세포가 이동하기 쉬워지고 미생물이 제거된다.[19]
비만 세포 편집
과립구형성 편집
과립구는 골수에 있는 줄기세포에서 유래한다. 과립구형성(Granulopoiesis)은 만능(pluripotent) 조혈모줄기세포가 공통 골수성 전구세포, 골수세포를 거쳐 과립구로 분화하는 과정이다.
관련 독성 물질 편집
과립구가 생산하거나 탈과립을 통하여 방출하는 독성 물질에는 아래와 같은 것들이 있다.
- 항미생물제 : 디펜신, 호산구 양이온성 단백질
- 효소
- 산성 소포(pH 3.5 - 4.0)
- 독성 질소 산화물(일산화질소)
- 독성 산소 화합물 : 초과산화물, 과산화수소, 하이드록시 라디칼, 일중항산소, 하이포할라이트 등
이 독성물질은 미생물을 섭취하거나 제거하는데 쓰인다.
병리학 편집
과립구감소증은 혈액에 과립구가 비정상적으로 적게 있는 상태를 말한다. 이 상태에서는 신체가 감염에 대항하는 능력이 감소한다. 유사한 상태로 무과립구증[주 1]과 호중구감소증이 있다. 과립구는 비장에서 4일, 혈류에서 하루나 이틀 정도 생존하기 때문에 수혈을 통하여 과립구를 공급하는 치료법은 매우 짧은 기간만 유효하다. 그 밖에 수혈과 연관된 문제도 많다.
인슐린 의존성 당뇨를 앓는 사람은 과립구의 화학주성에 결함이 있는 경우가 많다.
추가 그림 자료 편집
-
혈액세포 계보
-
조혈과정
-
조혈과정
같이 보기 편집
각주 및 참고 문헌 편집
내용주 편집
- ↑ 어원적으로는 과립구가 전혀 없는 것을 의미하지만, 임상적으로는 과립구 비율이 정상의 5% 이하인 경우를 말한다.
참조주 편집
- Delves, P.J., Martin, S. J., Burton, D. R. and Roit I.M. Roitt's Essential Immunology (11th edition), Blackwell Publishing, 2006, ISBN 978-1-4051-3603-7.
- ↑ “Definition of Granulocyte”. 2012년 3월 19일. 2014년 12월 24일에 원본 문서에서 보존된 문서. 2014년 11월 18일에 확인함.
- ↑ “Definition of Neutrophil”. 2012년 3월 19일. 2014년 12월 24일에 원본 문서에서 보존된 문서. 2014년 11월 18일에 확인함.
- ↑ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). 〈Neutrophils, central cells in acute inflammation〉. 《Inflammation and Fever from Pathophysiology: Principles of Disease》. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 80-967366-1-2. 2010년 12월 31일에 원본 문서에서 보존된 문서. 2009년 3월 28일에 확인함.
- ↑ Hoffbrand, A.V., Pettit, J.E., Moss, P.A.H. (2005). 《Essential Haematology》 4판. Blackwell Science. 331쪽. 다음 글자 무시됨: ‘ISBN 0-632-05153-1’ (도움말)
- ↑ 가 나 Abbas,Chapter 12, 5° Edition
- ↑ 가 나 Sompayrac, L. (2008). 《How the Immune System Works》 3판. Blackwell Publishing. 18쪽. 다음 글자 무시됨: ‘ISBN 978-1-4051-6221-0’ (도움말)
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F (December 1998). “Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates”. 《Pediatr. Res.》 44 (6): 946–50. doi:10.1203/00006450-199812000-00021. PMID 9853933. 2012년 4월 28일에 원본 문서에서 보존된 문서. 2009년 4월 6일에 확인함.
- ↑ Hickey, MJ; Kubes P (2009). “Intravascular immunity: the host–pathogen encounter in blood vessels”. 《Nature Reviews Immunology》 (Nature Publishing Group) 9 ((5)): 364–75. doi:10.1038/nri2532. PMID 19390567.
- ↑ Robinson J.P., Babcock G. F. ed (1998). 《Phagocyte Function -A guide for research and clinical evaluation》. Wiley–Liss. 187쪽. 다음 글자 무시됨: ‘ISBN 0-471-12364-1’ (도움말)
- ↑ Ernst J. D. Stendahl O. ed (2006). 《Phagocytosis of Bacteria and Bacterial Pathogenicity》. Cambridge University Press. 7–10쪽. 다음 글자 무시됨: ‘ISBN 0-521-84569-6’ (도움말)
- ↑ Paoletti R., Notario A. Ricevuti G. ed (1997). 《Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics》. The New York Academy of Sciences. 62쪽. 다음 글자 무시됨: ‘ISBN 1-57331-102-2’ (도움말)
- ↑ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L (January 2008). “Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages”. 《Clin. Exp. Immunol.》 151 (1): 139–45. doi:10.1111/j.1365-2249.2007.03532.x. PMC 2276935. PMID 17991288. 2012년 12월 9일에 원본 문서에서 보존된 문서. 2009년 3월 29일에 확인함.
- ↑ 가 나 다 Mayer, Gene (2006). “Immunology — Chapter One: Innate (non-specific) Immunity”. 《Microbiology and Immunology On-Line Textbook》. USC School of Medicine. 2008년 11월 12일에 확인함.
- ↑ Soehnlein O, Kai-Larsen Y, Frithiof R; 외. (2008년 10월). “Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages”. 《J. Clin. Invest.》 118 (10): 3491–502. doi:10.1172/JCI35740. PMC 2532980. PMID 18787642.
- ↑ Clark SR, Ma AC, Tavener AS, McDonald B, Goodarzi Z, Kelly MM, Patel KD, Chakrabarti S, McAvoy E, Sinclair GD, Keys EM, Allen-Vercoe E, DeVinney R, Doig CJ, Green FHY and Kubes P (2007년 4월). “Platelet Toll-Like Receptor-4 Activates Neutrophil Extracellular Traps to Ensnare Bacteria in Endotoxemic and Septic Blood” (PDF). 《Nature Medicine》 (Nature Publishing Group) 13 ((4)): 463–9. doi:10.1038/nm1565. ISSN 1078-8956. PMID 17384648.
- ↑ 가 나 Hess, Charles E. “Segmented Eosinophil”. University of Virginia Health System. 2009년 8월 13일에 원본 문서에서 보존된 문서. 2009년 4월 10일에 확인함.
- ↑ 가 나 Baron, Samuel (editor) (1996). 《Medical Microbiology》 4판. EditionThe University of Texas Medical Branch at Galveston. ISBN 0-9631172-1-1.
- ↑ Gleich GJ, Adolphson CR (1986). “The eosinophilic leukocyte: structure and function”. 《Advances in Immunology》. Advances in Immunology 39: 177–253. doi:10.1016/S0065-2776(08)60351-X. ISBN 9780120224395. PMID 3538819.
- ↑ 가 나 Campbell, Neil A., Reece Jane B., (2002). 《Biology》 6판. Pearson Education. 903쪽. 다음 글자 무시됨: ‘ISBN 0-8053-6624-5’ (도움말)
- ↑ Akuthota P, Wang HB, Spencer LA, Weller PF (August 2008). “Immunoregulatory roles of eosinophils: a new look at a familiar cell”. 《Clinical and Experimental Allergy : Journal of the British Society for Allergy and Clinical Immunology》 38 (8): 1254–63. doi:10.1111/j.1365-2222.2008.03037.x. PMC 2735457. PMID 18727793.
- ↑ Kariyawasam HH, Robinson DS (April 2006). “The eosinophil: the cell and its weapons, the cytokines, its locations”. 《Seminars in Respiratory and Critical Care Medicine》 27 (2): 117–27. doi:10.1055/s-2006-939514. PMID 16612762.
- ↑ Hess, Charles E. “Mature Basophil”. University of Virginia Health System. 2009년 8월 13일에 원본 문서에서 보존된 문서. 2009년 4월 10일에 확인함.
외부 링크 편집
- 의학주제표목 (MeSH)의 Granulocytes