하이포인산
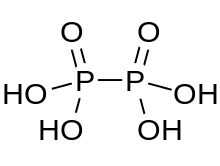
하이포인산(영어: hypophosphoric acid) 또는 차인산(次燐酸)은 산화수가 +4인 인을 가지고 있는 화학식이 H4P2O6인 무기산이다. 고체 상태에서는 이수화물인 H4P2O6·2H2O로 존재한다. 하이포인산에서 인 원자는 동일하며 P−P 결합으로 직접 연결된다. 아이소하이포인산(영어: isohypophosphoric acid)은 한 개의 인에 수소가 직접 결합되어 있고, 그 인 원자가 산소 다리에 의해 다른 하나와 연결되어 아인산/인산 혼합 무수물을 생성하는 하이포인산의 구조 이성질체이다. 두 개의 인 원자는 각각 +3 및 +5의 산화수를 갖는다.
| |
| 이름 | |
|---|---|
| IUPAC 이름
hypodiphosphoric acid
| |
| 별칭
diphosphoric acid
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| H4P2O6 | |
| 몰 질량 | 161.98 g/mol |
| 겉보기 | 흰색 고체 (이수화물) |
| 녹는점 | 54 °C (129 °F; 327 K) |
| 짝염기 | 하이포인산염 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
제법 및 반응 편집
하이포인산은 실온에서 적린과 아염소산 나트륨의 반응으로 제조할 수 있다.[1]
- 2 P + 2 NaClO2 + 2 H2O → Na2H2P2O6 + 2 HCl
하이포인산, 아인산(H3PO3) 및 인산(H3PO4)의 혼합물은 백린이 물에 부분적으로 잠겨 있을 때 공기 중에서 산화되어 생성된다.[1]
사나트륨 염인 Na4P2O6·10H2O는 pH 10에서 결정화되고, 이나트륨 염인 Na2H2PO6·6H2O는 pH 5.2에서 결정화된다.[2] 이나트륨 염은 이온교환 컬럼을 통과하여 산 이수화물인 H4P2O6·2H2O를 형성할 수 있다.[1]
무수산은 오산화 인에 대한 진공 탈수 또는 하이포인산 납(Pb2P2O6)에 대한 황화 수소의 반응에 의해 형성될 수 있다.[2]
하이포인산은 해리 상수가 pKa1 = 2.2, pKa2 = 2.8, pKa3 = 7.3 및 pKa4 = 10.0인 사양성자산이다.[2]
방치시 무수산은 자리옮김 및 불균등화를 거쳐 아이소하이포인산, HPO(OH)-O-PO2(OH), 피로인산(H2P2O7) 및 피로아인산의 혼합물을 형성한다.[2]
하이포인산은 뜨거운 염산에서 불안정하며, 4 M HCl에서는 가수분해되어 아인산(H3PO3) + 인산(H3PO4)을 생성한다.[2]
구조 편집
하이포아인산은 옥소늄 이온을 포함하고 있으며 화학식 [H3O+]2 [H2P2O6]2−로 나타낼 수 있다. 산은 219 pm의 P−P 결합 길이를 갖는 [HOPO2PO2OH]2− 음이온을 함유하고 있는 다이암모늄 염과 같은 구조이다.[1]
Na2H2P2O6·6H2O의 HOPO2PO2OH2− 음이온은 길이가 219 pm인 P−P 결합을 가진 대칭적이고 비틀림형 입체구조를 한 에테인과 같은 구조를 가지고 있다. 각 인 원자는 길이가 151 pm인 2개의 P−O 결합과 159 pm인 P−OH 결합을 가지고 있다.[3]
하이포인산염 편집
많은 하이포인산염들, 예를 들어 K4P2O6·8H2O, Ca2P2O6·2H2O, K3HP2O6·3H2O, K2H2P2O6·2H2O, KH3P2O6등이 알려져 있다.
공기 중에 있을 때 하이포인산염은 P
2O4−
7 이온을 포함하는 피로인산염으로 산화되는 경향이 있는데, 여기서 P는 산화수가 +5이다. 하이포인산염은 알칼리 수산화물에 안정하다. 융합된 수산화 나트륨에서 이들은 PO3−
4를 함유한 오르토인산염으로 빠르게 전환된다.[1]
폴리하이포인산염 편집
폴리하이포인산염은 선형 음이온을 포함하고 있는 것으로 알려져 있다. 예를 들어 P−P−P 사슬이 있는 O(PO
2)3O5−를 포함하는 Na5P3O8 및 P−P−P−P 사슬이 있는 O(PO
2)4O6−를 포함하는 Na6P4O10·2H2O이 있다. 각 인 원자가 +3의 산화수를 갖는 고리형 음이온 (PO
2)6−
6, (하이포헥사메타인산염[4])은 KOH에 있는 적린의 현탁액이 브로민으로 산화될 때 형성된다.[1]
같이 보기 편집
- 다이싸이온산 – 황 등가물
각주 편집
- ↑ 가 나 다 라 마 바 Phosphorus: Chemistry, Biochemistry and Technology, Sixth Edition, 2013, D.E.C. Corbridge, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ↑ 가 나 다 라 마 Greenwood, Norman N.; Earnshaw, Alan (1984). 《Chemistry of the Elements》. Oxford: Pergamon Press. 515–516쪽. ISBN 0-08-022057-6.
- ↑ Collin, R. L.; Willis, M. (1971). “The crystal structure of disodium dihydrogen hypophosphate hexahydrate (Na2H2P2O6·6H2O) and disodium dihydrogen pyrophosphate hexahydrate (Na2H2P2O7·6H2O)”. 《Acta Crystallographica Section B》 27 (2): 291–302. doi:10.1107/S0567740871002127. ISSN 0567-7408.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, p. 715, ISBN 0-12-352651-5