아인산 에스터
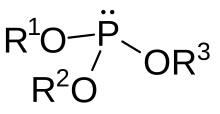
아인산 에스터(영어: phosphite ester)는 화학에서 일반적으로 화학식이 P(OR)3인 유기 인 화합물을 지칭한다. 유기아인산(영어: organophosphite)이라고도 한다. 이들은 관찰되지 않는 호변이성질체 아인산 H3PO3의 에스터로 간주될 수 있으며, 가장 단순한 예는 아인산 트라이메틸(P(OCH3)3)이다. 일부 아인산염은 아인산의 지배적인 호변이성질체(HP(O)(OH)2)의 에스터로 간주될 수 있다. 가장 단순한 아인산 에스터는 화학식이 HP(O)(OCH3)2인 다이메틸포스파이트이다. 이들 두 가지 아인산염은 일반적으로 무색의 액체이다.
합성
편집- PCl3으로부터
아인산 에스터는 일반적으로 삼염화 인을 알코올로 처리하여 제조된다. 합성의 세부 사항에 따라 이 알코올 분해 다이유기포스파이트()를 생성할 수 있다.[1]
- PCl3 + 3 C2H5OH → (C2H5O)2P(O)H + 2 HCl + C2H5Cl
대안적으로 알코올 분해가 양성자 수용체의 존재 하에 수행될 때 C3-대칭 트라이알콕시 유도체를 얻을 수 있다.[2]
- PCl3 + 3 C2H5OH + 3 R3N → (C2H5O)3P + 3 R3NHCl
두 가지 유형의 아인산염에 대해 수 많은 유도체가 제조되었다.
- 에스터교환반응에 의해
아인산 에스터는 다른 알코올과 함께 가열할 때 알코올 교환을 거치기 때문에 에스터교환반응으로 제조할 수도 있다.[3] 이 과정은 가역적이며 혼합 알킬 아인산염을 생산하는 데 사용할 수 있다. 대안적으로 아인산 트라이메틸과 같은 휘발성 알코올의 아인산염이 사용되는 경우, 부산물(메탄올)은 증류에 의해 제거되어 반응이 완료되도록 할 수 있다.
트리스(유기)포스파이트의 반응 및 활용
편집반응
편집트리스(2,4-다이-터트-뷰틸페닐)포스파이트, 중합체에서 널리 사용되는 안정제
아인산염은 다음과 같이 인산 에스터로 산화된다.
- P(OR)3 + [O] → OP(OR)3
이 반응은 중합체에서 안정제로 일부 아인산 에스터의 상업적 사용을 뒷받침한다.[4]
알킬 아인산 에스터는 바이닐 포스포네이트의 형성을 위한 퍼코우 반응과 포스폰산 형성을 위한 미카엘리스-아부조프 반응에 사용된다. 아릴 아인산 에스터는 이러한 반응을 겪지 않을 수 있으므로 일반적으로 PVC와 같은 할로젠 함유 중합체에서 안정제로 사용된다.
보다 특수한 경우에는 아인산 에스터를 환원제로 사용할 수 있다. 예를 들어 아인산 트라이에틸은 특정 하이드로과산화물을 자동 산화에 의해 형성되는 알코올로 환원시키는 것으로 알려져 있다.[5] 이 과정에서 아인산염은 인산 에스터로 전환된다. 이 반응 유형은 벤더 택솔 전합성에도 활용된다.
균질 촉매
편집아인산 에스터는 루이스 염기이므로 다양한 금속 이온과 배위 착물을 형성할 수 있다. 대표적인 아인산염 리간드로는 아인산 트라이메틸((MeO)3P), 아인산 트라이에틸((EtO)3P), 아인산 트라이메틸롤프로페인 및 아인산 트라이페닐((PhO)3P) 등이 있다. 아인산염은 구조적으로 관련된 포스핀 리간드 계열보다 더 작은 리간드 원뿔각을 나타낸다. 아인산염 리간드는 하이드로폼일화 및 하이드로사이안화를 위한 산업용 촉매의 구성 요소이다.[6]
HP(O)(OR)2의 화학
편집다이유기포스파이트는 인(III)의 유도체이며 아인산의 다이에스터로 볼 수 있다. 이들은 호변이성질화되지만 다음과 같이 평형은 압도적으로 오른쪽 형태(포스포네이트와 유사)를 선호한다.[9]
- (RO)2POH ⇌ (RO)2P(O)H
P-H 결합은 이러한 화합물(예: 애서턴-토드 반응에서의 예)에서 반응성이 높은 부위인 반면, 트라이유기포스파이트에서는 인의 고립전자쌍이 반응성이 높은 부위이다. 그러나 다이유기포스파이트는 에스터교환반응을 겪는다.
같이 보기
편집각주
편집- ↑ Malowan, John E. (1953). 〈Diethyl phosphite〉. 《Inorganic Syntheses》. Inorganic Syntheses 4. 58–60쪽. doi:10.1002/9780470132357.ch19. ISBN 9780470132357.
- ↑ A. H. Ford-Moore; B. J. Perry (1963). “Triethyl Phosphite”. 《Organic Syntheses》.; 《Collective Volume》 4, 955쪽
- ↑ Hoffmann, Friedrich W.; Ess, Richard J.; Usingef, Robert P. (November 1956). “The Transesterification of Trialkyl Phosphites with Aliphatic Alcohols”. 《Journal of the American Chemical Society》 78 (22): 5817–5821. doi:10.1021/ja01603a026.
- ↑ Rainer Wolf; Bansi Lal Kaul (2000). 〈Plastics, Additives〉. 《Ullmann's Encyclopedia Of Industrial Chemistry》. doi:10.1002/14356007.a20_459. ISBN 3527306730.
- ↑ J. N. Gardner; F. E. Carlon; O. Gnoj (1968). “One-step procedure for the preparation of tertiary α-ketols from the corresponding ketones”. 《J. Org. Chem.》 33 (8): 3294–3297. doi:10.1021/jo01272a055. PMID 5742870.
- ↑ Aitor Gual; Cyril Godard; Verónica de la Fuente; Sergio Castillón (2012). 〈Design and Synthesis of Phosphite Ligands for Homogeneous Catalysis〉. Paul C. J. Kamer; Piet W. N. M. van Leeuwen. 《Phosphorus(III) Ligands in Homogeneous Catalysis: Design and Synthesis》. John Wiley & Sons. 81–131쪽. doi:10.1002/9781118299715.ch3. ISBN 9781118299715.
- ↑ Cuny, Gregory D.; Buchwald, Stephen L. (1993). “Practical, High-Yield, Regioselective, Rhodium-Catalyzed Hydroformylation of Functionalized α-olefins”. 《Journal of the American Chemical Society》 115 (5): 2066–2068. doi:10.1021/ja00058a079.
- ↑ Van Rooy, Annemiek; Kamer, Paul C. J.; Van Leeuwen, Piet W. N. M.; Goubitz, Kees; Fraanje, Jan; Veldman, Nora; Spek, Anthony L. (1996). “Bulky Diphosphite-Modified Rhodium Catalysts: Hydroformylation and Characterization”. 《Organometallics》 15 (2): 835–847. doi:10.1021/OM950549K.
- ↑ Doak, G. O.; Freedman, Leon D. (1961년 2월 1일). “The Structure and Properties of the Dialkyl Phosphonates.”. 《Chemical Reviews》 61 (1): 31–44. doi:10.1021/cr60209a002.