화합물
화합물(化合物, 영어: compound 또는 chemical compound)은 두 종류 이상의 화학 원소의 원자가 결합하여 만들어진 순수한 화학 물질이며, 화학 반응을 통하여 더 단순한 물질로 분리해 낼 수 있다.[1] 이를테면 물(H2O)은 하나의 산소 원자마다 두 개의 수소 원자가 공유결합을 하여 만들어진 물질이다. 화합물은 고유한 화학적 구조를 가지고 있으며 이들은 화학 결합으로 하나가 된 일정한 비율의 원자로 이루어져 있다.[2] 화합물은 공유 결합에 의하여 하나로 된 분자 화합물이라고 할 수 있다. 이를테면 염은 이온 결합에 의하여 하나로 되고, 합금(금속을 결합시킨 것, 백랍 등)의 경우 금속 결합에 의하여 하나로 되며, 배위 착염은 배위 결합에 의하여 하나로 되는 분자 화합물이다.
 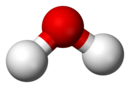 | |
| 순수한 물(H2O)은 화합물의 한 예이다. 위의 분자 공-막대 모형은 두 부분의 수소(흰색)과 한 부분인 산소(빨강)의 공간적 결합을 보여준다. |
한편, 순수한 화학 원소는 이것이 단일 원소(H2, S8 등)로 된 여러 개의 원자만 포함하는 분자들로 이루어져 있다고 할지라도 화합물로 간주하지 않는다.[1] 화합물은 오직 두 종류 이상의 원소들로 결합한 형태의 물질들을 이르기 때문이다. 위의 단일 원소(H2, S8 등)는 홑원소 물질이라고 부른다.
기본 개념
편집화합물의 특성은 다음과 같다:
- 화합물의 원소는 일정한 비율로 존재한다. (예: 2개의 수소 + 1개의 산소는 하나의 화합물 분자인 물이 된다)
- 화합물은 일정한 집합의 특성을 갖는다. (화합물의 원소는 원래의 특성을 보유하고 있지 않다.)
- 화합물의 원소는 물리적인 방식으로 분리할 수 없다.
공식
편집화학자들은 화합물을 다양한 형태의 공식을 이용하여 서술한다. 분자로 존재하는 화합물의 경우 분자 단위의 공식이 이용된다. 광물과 수많은 금속 산화물과 같은 중합체의 경우 일반적으로 실험식이 이용된다. 이를테면 염화 나트륨의 경우 NaCl로 표기한다.
화학 공식의 원소는 일반적으로 특정한 순서로 나열되는데 이를 힐 시스템(Hill system)이라고 한다. 이러한 체계에서 탄소 원자들은 일반적으로 맨 처음에, 수소 원자는 그 다음에, 다른 모든 원소는 알파벳 순으로 그 뒤에 나열된다. 화학식이 탄소를 포함하지 않으면 수소를 포함한 모든 원소는 알파벳 순으로 나열된다. 그러나 이러한 일반적인 법칙에도 예외는 있다. 이온 화합물의 경우 양이온은 거의 언제나 맨 먼저 오고 음이온은 두 번째에 온다. 산화물의 경우 산소가 맨 마지막에 나열된다.
상과 열 특성
편집화합물은 몇 가지 가능한 상을 가질 수 있다. 모든 화합물은 적어도 충분히 낮은 온도에 있다면 고체로 존재할 수 있다. 분자 화합물은 액체, 기체, 또 특별한 경우 플라스마로 존재할 수도 있다. 모든 화합물은 열에 의해 분해된다. 이러한 분해가 일어나는 온도는 분해 온도라고 한다. 분해 온도는 열의 속도에 따라 달라지며 가파르게 바뀌지는 않는다.
CAS 번호
편집종류
편집같이 보기
편집각주
편집- ↑ 가 나 Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st ed.), Upper Saddle River, NJ: Pearson/Prentice Hall, p. 36, ISBN 0-13-251210-6
- ↑ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th ed.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, p. 15, ISBN 978-0-03-072373-5