활동일 주기
하루주기리듬(circadian rhythm) 또는 활동일주기(活動日週期, sleep-wake circadian cycle) 또는 일주율 또는 일주기리듬 또는 일일주기리듬은 식물, 동물, 균류, 심지어 박테리아까지 포함하는 지구 상의 생명체들에서 생화학적, 생리학적, 또는 행동학적 흐름이 거의 24시간의 주기로 나타나는 현상이다. 생물에서 하루, 조수, 주간, 계절, 그리고 일 년과 같이 시간에 따른 리듬을 연구하는 학문을 시간 생물학(chronobiology)라고 한다. 생체 리듬은 체내에서 발생하지만 일주기 생체 리듬은 빛, 어둠, 기온과 같은 외부의 요인들에 의해 환경에 알맞게 동기화하는데 이를 차이트게버(Zeitgeber, 독일어 ‘시간 기여자’)라고 한다. 차이트게버 중에서도 빛은 가장 큰 영향력을 가진다.
역사
편집최초에 생체 시계에 대해 고려된 것은 기원전 4세기경으로 알렉산더 대왕 휘하의 선장이 낮 동안에 콩과 식물(tamarind)의 잎의 움직임을 관찰하면서였다. 현대에 이르러 18세기 프랑스 과학자 드 메랑(Jean-Jacques d’Ortous de Maran)은 Mimosa pudica라는 식물이 지속적인 어둠 속에서두었을 때도 24시간을 주기로 계속해서 잎이 움직인다는 것을 발견하였다.[1] 한 세기 후에는 스위스의 박물학자 드 캉돌(Augustin Pyramus de Candolle)은 자연상에서는 미모사의 잎이 24시간을 주기로 움직이지만 불규칙하게 조명을 주었을 때는 20-28시간을 주기로 움직임을 알아내었다.[2] 일주기 생체 시계에 대한 연구는 식물뿐만 아니라 동물에서도 이루어졌다. 1894년에 명암이 주어지지 않은 상태에서 절지동물의 지속적인 색의 변화를 키셀이 관찰하였다. 브래디는 바퀴벌레를 비 주기적인 환경에 두면 외부의 자극 요인 없이도 일주기로 리듬이 유지되지만 완벽하게 24시간에 맞지 않으며 주기적 환경에 다시 둘 경우 원래의 리듬을 회복함을 실험을 통해 밝혀냈다. 또한 초파리는 계속 빛이 공급되는 환경에서도 700세대에 걸쳐 일주기 생체 리듬이 유지되었으며[3] 메추라기는 실험적으로 빛을 제거하였을 때 행동뿐만 아니라 생리적으로도 리듬이 유지된다는 것이 알려져 있다.[4]
식물에서의 일주기 생체 리듬
편집식물의 생체리듬은 계절이 어떠한지, 꽃이 수분하기 위해 곤충을 유혹하는데 가장 최고의 시기는 언제인지를 알려준다. 이는 잎의 움직임, 성장, 발아, 기공을 통한 기체교환, 효소 활성, 광합성 작용, 향기의 분출 등을 포함한다.[5] 주로 빛을 이용하고, 식물의 내부에서 발생하며, 독립적이고, 상대적으로 주위의 온도에 관계없이 일정하다. 또한 식물에서의 생체 리듬은 전사과정에서의 피드백 루프, PAS 단백질의 존재, 서로 다른 빛 조건에서 미세하게 시계를 조절할 수 있는 광수용기로 특징된다. 환경 변화에 대해 예측하는 것은 식물에게 생리적 상태를 변화시킴으로써 적응하는데 유리하게 작용할 수 있다.[6]
생체 시계는 빛, 온도, 영향상태와 같은 외부 요인에 의해 조정된다. 그 결과, 식물 내부의 시계는 일반적인 시간의 흐름과 일치하게 된다. 빛은 다양한 광수용기에 의해 인식된다. 붉은 빛이나 푸른 빛은 각각 피토크롬(phytochrome)과 크립토크롬(cryptochrome)을 통해 흡수된다. 특히 크립토크롬(cry) 유전자는 빛에 의해 생체 리듬에 관여하는 중요한 요인 중 하나이다. 크립토크롬 1-2는 모든 빛에 대해 시계의 주기를 유지시켜준다.[5][6]
생체 리듬이 독립적으로 일어나는데 주로 작용하는 요인은 CCA1, LHY, 그리고 TOC1라는 유전자들이다. 일반적으로 CCA1과 LHY가 아침에 작용한다면, TOC1은 이른 저녁에 작용한다. 이는 CCA1과 LHY의 발현과 TOC1의 발현은 서로 음성적인 피드백 관계에 있다.[6]
동물에서의 일주기 생체 리듬
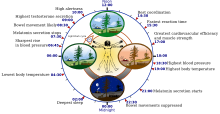
편집24시간을 주기로 하는 생체 리듬은 인간을 포함한 동물들에서 수면과 섭식에 관여한다. 뿐만 아니라 체온, 뇌파활동, 호르몬 생성, 세포 재생성 등과 같은 생물학적 활동의 패턴에도 관여한다. 게다가 낮의 길이에 따른 광주기성은 식물에서만 나타나는 것이 아니라 동물에서도 생리학적으로 매우 중요한 역할을 한다.
극지방의 동물들
편집노르웨이의 한 연구진은 일부 극지방 동물에서 한 해 중에서 일출과 일몰이 있는 때에만 일주기 생체 리듬이 나타난다고 보고하였다. 순록에 대한 한 연구에서는 북위 70도 지역에서 생체 리듬이 여름에 나타나지 않았으며 북위 78도 지역에서는 가을과 봄에만 리듬이 나타났다. 연구진은 극지방의 여름에는 계속 밝고, 겨울에는 계속 어둡기 때문에 이 같은 현상이 보여지는 것이라고 추측하였다.[7]
하지만 북부 알래스카에서의 또 다른 연구에서는 땅다람쥐와 포쿠파인에서 82일간 낮이 지속되는 동안에도 일주기 생체 리듬이 정확히 유지됨이 나타났다. 이들은 이 두 작은 포유류가 하루에 한 번 태양과 수평선의 거리가 가장 짧아지는 것을 신호로 하여 생체 리듬을 조정하는 것으로 보인다.[8]
생체 리듬의 기작
편집포유류에서 생체 시계가 유지되는데 가장 중요한 역할을 하는 것이 시상하부에 위치한 시각교차 위핵(suprachiasmatic nucleus, SCN)이다. SCN의 손상이 생체 리듬에 대한 타이밍을 파괴한다는 사실이 밝혀진 것은 1970년대이다.[9] 1990년에 이르러 햄스터를 이용한 실험에서 SCN에 일간 주기를 조절하는 인자가 있다는 사실이 실험을 통해 입증되었다.[10] SCN이 제 기능을 하지 못하면 규칙적인 수면과 기상에 관련된 리듬이 완전히 사라지게 된다.
SCN은 눈을 통해 빛에 대한 정보를 받는다. 망막은 시각에 관여하는 일반적인 광수용기일 분만 아니라 광 민감성을 가지는 신경절 세포(photosensitive ganglion cells)를 포함한다. 이 세포들은 멜라놉신(melanopsin)이라고 불리는 광수용체를 포함하고 있으며 이를 통해 빛을 인지한다. 인지된 빛은 망막시상하부(retinohypothalamic tract, RHT)를 통해 SCN으로 전달되어 생체 리듬에 영향을 미치게 된다. 즉, SCN은 망막으로부터 낮과 밤의 길이에 대한 정보를 받아들이며 이를 해석하고 시상하부에 있는 송과선으로 신호를 보낸다. 송과샘에서는 멜라토닌을 분비하는데 밤에는 최고에 도달하고 낮에는 분비량이 감소한다. 즉, 멜라토닌이 밤의 길이에 대한 정보를 제공한다고 할 수 있다.
일주기 생체 주기 측정 상태 지표
편집일반적인 생체 리듬의 주기를 측정하기 위한 상태 지표는 다음과 같다.[11]
- 송과체에서의 멜라토닌 분비
- 심부 체온[12]
- 코르티솔(부신 피질 호르몬)의 혈장 수준
멜라토닌은 낮 시간 동안에는 아예 나타나지 않거나 거의 확인되지 않는다. 저녁 9시경에 멜라토닌의 분비가 시작되는데 (dim-light melatonin onset, DLMO) 이는 혈액이나 침에서 측정할 수 있으며 이는 모두 생체 리듬의 마커로 사용되어 왔다. 하지만 최근의 연구 결과에 의하면 멜라토닌이 사라지는 쪽을 측정하는 것이 더 믿을 만한 마커인 것으로 나타나고 있다. 한 연구에서는 멜라토닌 상태 마커는 체온보다 수면하는 시기와 더 안정적이고 높은 상관관계를 가짐을 발견하였다. 그들은 수면에서 깨어나는 것과 멜라토닌의 분비가 멈추는 것이 잠이 드는 것을 측정하는 것보다 더 다양한 상태지표들과 높은 상관관계를 보임을 나타냈다. 뿐만 아니라 멜라토닌 수준의 감소하는 상태는 멜라토닌의 생성이 정확히 중지되는 것을 측정하는 것보다 더 믿을 만하고 안정적인 마커가 될 수 있는 것으로 나타났다.[12] 멜라토닌의 생성이 제거되는 것을 측정하는 또 다른 방법은 아침에 분비된 소변 샘플에서 멜라토닌의 대사작용으로 인해 생성된 aMT6s (melationin metabolite 6-sulphatoxymelatonin)을 측정하는 것이다. 이 방법을 이용하여 건강한 청소년에서 종종 생체 리듬의 주기가 늦춰지는 것을 발견하였다.[13]
멜라토닌 외에 정상적인 사람의 체내 일간주기는 범위가 매우 넓은데 성인을 기준으로 보통 습관적으로 깨어나기 2시간 전인 새벽 5시경에 가장 체온이 낮아지는 것을 이용하여 생체 시간을 측정한다. 부신피질의 혈장 수준이 최대가 되는 시기를 측정하는 것 또한 인간의 생체 시간을 측정하는데 마커로써 이용된다. 하지만 위의 세 가지 방식으로 생체 주기를 측정하여 비교한 한 연구 결과에서는 멜라토닌의 측정이 다른 두 가지 마커보다 상당히 믿을 수 있을 것으로 보았다.[11]
빛과 생체 리듬
편집앞서 언급하였듯이 빛은 일주간 생체 리듬에 가장 큰 영향을 주는 자이트게버이다. 대체로 동물들은 외부의 영향을 받지 않고 자체 내에서 생기는 리듬을 유지하는데 이를 자유가동(free-running)이라고 한다. 지하에서 평생을 보내는 장님쥐(Spalax sp.)와 같은 포유류도 빛에 의한 외부 자극이 완전히 없는 것으로 보이는 상태에서도 체내의 시계를 유지할 수 있다. 그들은 형상을 구성하는 눈은 없지만 빛수용기는 여전히 기능을 하고 있기 때문에 주기가 나타나는 것으로 보인다.[14]
일반적으로 자유가동을 하는 대부분의 유기체들은 기본적으로 유사한 위상 반응 곡선 (phase response curve, PRC)을 갖는다. 일주기 생체 리듬의 주기가 정확히 24시간이 아니기 때문에 빛이 주어지지 않은 상태에서는 위상의 변화가 일어나면서 그 다음 날의 활동 리듬이 앞당겨지거나 혹은 지연된다. 빛은 점차 변화하는 생물학적 시계를 재조정한다. 시점에 따라 빛은 생체 주기를 더 빠르게 하거나 늦춤으로써 24시간의 주기를 맞출 수 있다.[15] 사람을 대상으로도 위상 반응 곡선의 변화에 대해 실험된 바 있으며 모든 환경이 고정된 고립 상태에서 주기가 24시간으로 유지되지 않는 것이 나타났다.[16] 이 같은 사실은 시계의 분자 성분들의 상호 작용을 통한 동조 메커니즘을 설명하는데 이용된다. 야행성 설치류가 인간보다 시계를 조절하기 위하여 적은 양의 빛을 필요로 하는 것처럼, 종에 따라서 PRC와 필요한 빛의 양은 다르다.
인간의 경우, 리듬에 영향을 주는 빛의 수준은 실내의 인공적인 빛보다는 보통 더 높다. 한 연구에 의하면 생체 주기 체계를 자극하는 빛의 세기는 망막을 자극하는 1000lux 정도라고 한다. 빛의 방향 또한 생체 주기에 영향을 미칠 수 있는 것으로 보인다. 하늘과 같이 위에서부터 오는 빛은 아래에서 눈으로 오는 빛보다 더 강한 영향력을 미친다고 한다.[17]
빛의 세기뿐만 아니라 빛의 파장 또한 체내 시계의 동조의 요인 중 하나이다. 멜라놉신은 연구에 따라 조금씩 다르지만 푸른 빛의 일부인 420-440nm의 빛에서 가장 효과적으로 자극을 받는다.[18] 이러한 푸른 파장은 사실상 거의 모든 빛에 존재하므로 이 빛을 제거하기 위해서는 붉은 빛이 나는 필터를 사용하거나 매우 특수한 빛이 필요하게 된다.
최근의 연구에 따르면 일광은 생체 리듬에 직접적인 영향을 미치며 결과적으로 행동이나 건강에도 영향을 줄 수 있다고 한다. 연구진은 아침에 조명 방식에 문제를 경험한 학생들이 수면 패턴에 혼란이 나타날 수 있다고 하였다. 수면 패턴의 변화는 학생의 행동이나 각성도에 부정적인 영향을 줄 수 있다. 아침에 주기적인 빛을 제거하면 DLMO가 하루에 6분식 늦어지며 5일이 지나면 총 30분이나 늦어지게 된다.[19]
생체 시계의 분자 요인
편집생체 시계(biological clock)에 대한 기본적인 이해는 원핵생물인 시아노 박테리아에서 시작되었다. 최근 연구에서는 synechococcus elongatus에서 생체 리듬에 관여하는 카이(kai) 유전자 덩어리(kaiA, kaiB, kaiC)를 발견하였다. kaiA는 아침에 발현하여 나머지 두 유전자의 발현을 유도하며 세 종류의 유전자들 간의 피드백 모델을 통해 생체 리듬을 유지한다. 이 유전자들은 생체 주기에는 영향을 미치는 생존에는 전혀 관여하지 않는다고 한다.[20]
1971년, 코나카(Ronald J. Konoka)와 벤저(Seymour Benzer)가 초파리를 모델 생물로 하여 최초로생물학적 시계의 유전적 요소를 밝혀내었다. 이들은 일간주기가 짧아지거나 길어지는 비정상적인 행동이 나타내는 세 개의 돌연변이 형태를 찾아냈으며 이 돌연변이들은 모두 한 유전자의 변이에 의해 발생했음을 알아냈다. 이 유전자는 “period” 또는 “per”라고 명명되었다.[21] 1988년에는 랄프와 메나커가 일반적인 24시간 주기가 아닌 22시간의 주기를 가진 한 수컷 햄스터로부터 일간주기에 관여하는 tau 유전자 발견하였다. 이 유전자가 비정상인 경우, 한 쌍 모두 정상일 때보다 일간주기가 짧아지는 것으로 나타났다.[22] Period(PER) 유전자와 그 단백질이 일주간 생체 주기에 어떤 방식으로 영향을 미치는지에 관한 모델은 꾸준히 연구되어 1994년에 쥐를 대상으로 하여 clock이라고 하는유전자가 발견되었다. clock(CLK)은 일간주기 운동 출력 체계가 파손된 유전자 (Circadian Locomotor Output Cycles Kaput) 라는 의미라고 한다.[23] 초파리에서도 쥐의 clock에 해당하는 유전자가 밝혀졌으며 여기에서 생성된 단백질은 특정한 암호를 가진 또 다른 단백질과 결합한다. 이 암호를 지정하는 유전자는 cycle이라고 불린다. 현재 가장 인정받고 있는 초파리에서의 분자시계 모델은 동조 경로까지 포함하여 나타내고 있다.[24] 포유류에서는 cry 유전자와 per 유전자가 다이머(dimer)를 형성하고 분해됨으로써 분자 시계의 자동 조절 음성 피드백 회로를 구성하고 이를 통해 일간주기를 유지한다.[25]
사람의 일주기 생체 리듬
편집인간의 실제 생체 리듬은 지구의 24시간보다 미세하게 짧거나 길다. 매우 제한된 환경 하에서 최근의 연구에 의하면 평균적으로 성인에서 24시간보다 약간 생체 주기가 더 길게 나타난다고 한다. 하버드의 한 연구진은 최근 인간은 적어도 23.5시간에서 24.65시간 주기를 가지고 있음을 밝혀냈다.[26]
생체 리듬 이상에 의한 유전적 질병
편집가족성 전진성 수면위상 증후군(FASPS: familial advanced sleep-phase syndrome)을 가진 사람은 일반적인 수면/기상 사이클이 정상인보다 3~4시간 짧게 나타난다. 따라서 저녁 7시 이후에 잠이 들고 새벽에 기상하게 된다. 이 장애는 유전성이며 대체로 2번 염색체 상의 Per2 유전자에 돌연변이가 발견되었다. 이 유전자에서 발현되는 hPer2 단백질의 이상은 일간주기 리듬의 길이를 유지하는 과정이 원활하게 이루어지는 것을 방해한다. 그러나 FASPS를 앓는 사람들이 모두 이 유전자에 이상을 가진 것은 아니며, 나머지 사람들의 경우에는 멜라토닌 리듬과 관계 있는 유전자들이 관여했을 수도 있는 것으로 보인다.[27]
불면증으로 인하여 원하는 시간에 잠들거나 깨어나지 못하고 항상 과도한 졸음에 시달리는 사람들도 있다. 이는 지연성 수면위상 증후군 (DSPS: delayed sleep-phase syndrome)이다.[28] 이 증후군의 원인은 정확히 알려진 것은 없으나 FASPS와 같이 일간주기 리듬 위상이 지속적으로 이상이 생김으로써 나타나는 것으로 보인다. 그러나 청소년기에 DSPS가 나타나는 경우 10대를 벗어나면서 자연스럽게 극복되는 경우도 있으므로[29] 유전적인 원인에 의한 FASPS와는 다르게 접근하는 것이 필요하다.
일주기 생체 시계와 건강
편집영국에서는 약 3퍼센트가 가을이나 겨울에 계절성정서장애(SAD: seasonal affective disorder)를 겪는다고 한다. 이 질병은 봄이 되면 증상이 호전되는데 이 증상은 동물들이 동면할 때 에너지를 절감하는 현상과 유사하다. 이는 인간의 일간주기 속도조정자는 계절에 따른 낮 길이의 변화를 감지하는 능력을 지금까지 보존하고 있음을 보여준다.
시차가 큰 지역으로 여행을 다녀오게 되면 모든 생체 리듬이 현지와 동조하지 못하고 혼란에 빠진다. 시차증은 판단 능력, 의사소통 능력, 기억력, 주의력 등 많은 부분에 있어 매우 큰 영향을 미칠 수 있다고 한다. 일반적으로 동쪽에서 서쪽으로 이동할 때보다 서쪽에서 동쪽으로 이동할 때 시차증은 더욱 심하게 나타난다.[30] 시차증이 위험한 이유 중 하나는 SCN은 적응이 비교적 빠른 반면 다른 기관들은 더 오래 걸리기 때문이다. 특히 간은 주기가 변화하기까지 2주에 가까운 시간이 걸린다.[31]
빛에 동조하지 못하거나 일주기 생체 리듬을 맞추지 못하는 경우 화학적 치료제인 멜라토닌을 이용하기도 한다. 멜라토닌은 천연 호르몬이므로 무작위적으로 복용이 이루어지고 있다. 하지만 멜라토닌을 적절하지 못한 시간에 투여하게 되면 오히려 생체 리듬이 더욱 파괴되어 부정적인 효과를 얻을 수 있다.[32]
같이 보기
편집- 시간생물학
- 후성유전학
- 생체시계 (노화) (en:Biological clock (aging))
- 송과선
- 시교차 상핵
- 멜라놉신
- 내재적인 감광성 망막 신경절 세포(intrinsically photosensitive retinal ganglion cell)
참고 문헌
편집- 러셀 포스터, 레오 크라이츠먼, 《바이오클락: 세상 모든 생명체를 지배하는 생체시게의 비밀을 찾아서》, 김한영, 황금부엉이, 2006
- 한상신, 《바이오 리듬의 규명과 응용: 생명의 시계》, 아카데미서적, 1993
- 알랭 랭베르, 《생체 시계란 무엇인가?》, 곽은숙, 민음사, 2006
- 장혜진, 《건강 잠재력, 생체시계의 비밀》, 지식채널, 2009
각주
편집- ↑ de Mairan, J. J. O. (1729). “Observation botanique”. Histoire de l’ Acadèmie Royale des Sciences: 35-36.
- ↑ de Candolle, M. (1832). De I’influence de la lumière sur les végétaux. Physiolvég 4: 1069.
- ↑ Sheeba V, Sharma VK, Chandrashekaran MK, Joshi A. (1999). "Persistence of eclosion rhythm in Drosophila melanogaster after 600 generations in an aperiodic environment". Die Naturwissenschaften 86(9): 448–9. doi:10.1007/s001140050651. PMID 10501695.
- ↑ Guyomarc'h C, Lumineau S, Richard JP. (1998). "Circadian rhythm of activity in Japanese quail in constant darkness: variability of clarity and possibility of selection". Chronobiology International 15 (3): 219–30. doi:10.3109/07420529808998685. PMID 9653576.
- ↑ 가 나 Webb, Alex A R. (2003). “The physiology of circadian rhythms in plants”. New Phytologist 160: 281-303. DOI: 10.1046/j.1469-8137.2003.00895.x
- ↑ 가 나 다 McClung, C. Robertson. (2006). "Plant Circadian Rhythms”. The Plant Cell 18: 792-803.
- ↑ van Oort BE, Tyler NJ, Gerkema MP, Folkow L, Blix AS, Stokkan KA. (2005) “Circadian organization in reindeer”. Nature 438: 1095-6.
- ↑ Folk, G. E., Thrift, DL. Zimmerman, M. B., Reimann, P. C. (2006) “Mammalian activity – rest rhythms in Arctic continuous daylight”. Biological Rhythm Research 37(6): 455-469. DOI: 10.1080/09291010600738551
- ↑ Friedrich KS. and Zucker I. (1972). “Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions”. PNAS 69(6): 1583-1586.
- ↑ Ralph, MR., foster, RG., Davis, FC. and Menaker, M. (1990). “Transplanted suprachiasmatic nucleus determines circadian period”. Science 247: 975-78. DOI: 10.1126/science.2305266.
- ↑ 가 나 Klerman, Elizabeth B.; Hayley B. Gershengorn, Jeanne F. Duffy, Richard E. Kronauer (2002). "Comparisons of the Variability of Three Markers of the Human Circadian Pacemaker". J Biol Rhythms 17 (2): 181-193. doi:10.1177/074873002129002474. Retrieved 2010-10-09.
- ↑ 가 나 Benloucif S, Guico MJ, Reid KJ, Wolfe LF, L'hermite-Balériaux M, Zee PC (2005). "Stability of melatonin and temperature as circadian phase markers and their relation to sleep times in humans". J Biol Rhythms 20 (2): 178–88. doi:10.1177/0748730404273983.PMID 15834114.
- ↑ Laberge, L.; Lesperance, P.; Tremblay, R.; Lambert, C.; Montplaisir, J. (1997). "Phase delay of 6-sulphatoxymelatonin in normal adolescents". Sleep Research 26: 727.
- ↑ Foster RG, Kreitzman L. (2005). “Rhythms of life: The biological clocks that control the daily lives of every living thing”. Yale Univ Pr.
- ↑ Hastings, JW. Sweeney, BM. (1958). “A persistent diurnal rhythm on luminescence in Gonyaulax polyedra”. Biol Bull 115: 440-458.
- ↑ Aschoff, J. Gerecke, U. Wever, R. (1967). “Phase relations between the circadian activity periods and core temperature in humans”. [In german]. Pfügers Arch Gesamte physiol Menschen Tiere 295: 173-83.
- ↑ Semjonova, Milena (2003). "Healthy Lighting, from a lighting designer's perspective". Milena Lighting Design.
- ↑ Newman LA, Walker MT, Brown RL, Cronin TW, Robinson PR (2003). "Melanopsin forms a functional short-wavelength photopigment". Biochemistry 42 (44): 12734–8.doi:10.1021/bi035418z. PMID 14596587.
- ↑ Figueiro MG, Rea MS (2010). "Lack of short-wavelength light during the school day delays dim light melatonin onset (DLMO) in middle school students". Neuro Endocrinology Letters 31 (1): 4. PMID 20150866.
- ↑ Xu, Y. Mori, T. Johnson, C. H. (2003). “Cyanobacterial circadian clockwork: roles of KaiA, KaiB, and the KaiBC promoter in regulating KaiC”. The EMBO Journal 22: 2117-2126. doi:10.1093/emboj/cdg168.
- ↑ Knopka, JR. Benzer, S. (1971). “Clock mutants of Drosophila melanogaster”. Proc NatlAcad Sci USA 68: 2112-16.
- ↑ Ralph, MR. Menaker, M. (1988). “A mutation of the circadian system in golden hamsters”. Science 241: 1225-27.
- ↑ Viaterna, MH. King, DP. Char, A. Kornhauser, JM. Lowrey, PL. McDonald, JD. Dove, WF. Pinto, LH. Turek, FW. And Takahashi, JS. (1994). “Mutagenesis and mapping of a mouse gene, clock, essential for circadian behavior”. Science 264: 719-25.
- ↑ Hall, JC. (2003). “Genetics and molecular biology of rhythms in Drosophila and other insects”. Adv Genet 48: 1-280. doi:10.1016/S0065-2660(03)48000-0
- ↑ Reppert, MR. Weaver, DR. (2002). “Coordination of circadian timing in mammals”. Nature 418: 935-941. doi:10.1038/nature00965.
- ↑ Scheer FA, Wright KP, Kronauer RE, Czeisler CA (2007). "Plasticity of the intrinsic period of the human circadian timing system". PLos ONE 2 (1): e721. doi: 10.1371/journal.pone.0000721. PMID 17684566.
- ↑ Toh, KL. Jones, CR. He, Y. Eide, EJ. Hinz, WA. Virshup, DM. Ptácek, LJ. Fu, YH. (2001). “An hPer2 phosphorylation site mutation in familial advanced sleep phase syndrome”. Science 291: 1040-43. DOI: 10.1126/science.1057499
- ↑ Dement, WC. Vaughan, C. (1999). “The promise of sleep”. Macmillan. London.
- ↑ Okawa, M. Uciyama, M. Ozaki, S. Shibui, K. Ichikawa, H. (1998). “Circadian rhythm sleep disorders in adolescents: clinical trials of combined treatments based on chronobiology”. Psychiatry Clin neurosci 52: 483-490. DOI: 10.1046/j.1440-1819.1998.00449.x
- ↑ Recht, LD. Lew, RA. Schwartz, WJ. (1995). “Baseball teams beaten by jet lag”. Nature 377: 583. PMID 7566168
- ↑ Yamazaki, S. Numano, R. Abe, M. Hida, A. Thkahashi, R. Ueda, M. Block, GD. Sakaki, Y. Menaker, M. Tei, H. (2000). “Resetting central and peripheral circadian oscillators in transgenic rats”. Science 288: 682-85. DOI: 10.1126/science.288.5466.682
- ↑ Arendt, J. Deacon, S. English, J. Hampton, S. Morgan, L. (1995). “Melatonin and adjustment to phase shift”. J Sleep Res 4: 74-79. DOI: 10.1111/j.1365-2869.1995.tb00232.x
외부 링크
편집- (영어) 활동일 주기 - Curlie