사용자:이강철 (WMKR)/2024년 과학의 달 에디터톤 심사/글루코스
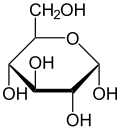 α-d-글루코피라노오스의 하스 투영
| |
 d-글루코스의 피셔 투영
| |
| 이름 | |
|---|---|
| 발음 | /ˈɡluːkoʊz/, /ɡluːkoʊs/ |
| IUPAC 이름
Systematic name:
(2R,3S,4R,5R)-2,3,4,5,6-Pentahydroxyhexanal allowed trivial names: | |
| 우선명 (PIN)
PINs are not identified for natural products. | |
| 별칭
Blood sugar
Dextrose Corn sugar d-Glucose Grape sugar | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 3DMet | |
| 약어 | Glc |
| 1281604 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC 번호 |
|
| 83256 | |
| KEGG | |
| MeSH | Glucose |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
| |
| |
| 성질 | |
| C6H12O6 | |
| 몰 질량 | 180.156 g/mol |
| 겉보기 | White powder |
| 밀도 | 1.54 g/cm3 |
| 녹는점 | α-d-Glucose: 146 °C (295 °F; 419 K) β-d-Glucose: 150 °C (302 °F; 423 K) |
| 909 g/L (25 °C (77 °F)) | |
자화율 (χ)
|
−101.5×10−6 cm3/mol |
| 8.6827 | |
| 열화학 | |
열용량 (C)
|
218.6 J/(K·mol)[1] |
표준 몰 엔트로피 (S
|
209.2 J/(K·mol)[1] |
표준 생성 엔탈피 (ΔfH⦵298)
|
−1271 kJ/mol[2] |
연소열, 고위발열량 (HHV)
|
2,805 kJ/mol (670 kcal/mol) |
| 약리학 | |
| B05CX01 (WHO) V04CA02, V06DC01 | |
| 위험 | |
| 물질 안전 보건 자료 | ICSC 08655 |
| NFPA 704 (파이어 다이아몬드) | |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
글루코스(glucose), 포도당(葡萄糖)으로 부르는 물질은 알데하이드 기를 가지는 당의 일종으로 사슬 모양보다는 육각고리형 모양으로 흔히 존재한다. 분자식은 C6H12O6 분자량은 약 180이다. 다당류로 결합했을 때의 형태에 따라 알파(alpha) 형과 베타(beta) 형이 있다.
뇌, 신경, 폐 조직에 있어서 글루코스는 에너지원으로 필수적이며 혈중 글루코스 농도에 민감하게 반응하여 결핍증이 되면 즉각 경련을 일으키게 된다. 혈당량이 낮아지면 '글리코겐 부채'가 발생하거나, 포도당 쇼크로 사망할 수도 있다. 그러나 혈당량이 너무 높아지면 당뇨병에 걸린다.
D형·L형 2종의 광학이성질체가 있는데, 천연으로는 D형만이 존재하며, L형은 녹말이 효소에 의해 분해될 때 생성된다. D형은 덱스트로스(dextrose)라고도 부른다. 달콤한 과즙, 동물의 혈액·림프액 등에 유리상태로 존재하는 이외에, 글리코겐·녹말·셀룰로스 등의 다당류, 설탕 등의 소당류 및 여러 배당체의 구성 성분으로서, 또한 세포벽의 구성성분으로서 자연계에 널리 존재한다.
포도당은 탄수화물 대사의 중심적 화합물로서 그 이용 경로는 매우 복잡하며, 에너지원으로서 분해되는 경로는 특히 중요하다. 포도당은 먼저 헥소키네이스의 작용으로 글루코스 6인산이 되고, 해당과정(glycolysis,글리콜리시스)을 거쳐서 피루브산으로 분해된다. 또한, 호기성 과정에서는 TCA회로를 거쳐서 이산화탄소와 물로 분해된다.
- C6H12O6 + 6O2 → 6CO2 + 6H2O + 686kcal
포도당의 분해 편집
포도당은 이러한 세포호흡을 통해 분해되어 에너지를 생산하고, 그 에너지는 ATP의 형태로 저장된다. 이 에너지는 발효·호흡 등에 사용된다. 한편, 필요할 때까지 포도당을 저장해 두는 경로도 존재한다. 동물에서는 포도당이 우리딘삼인산과 반응하여 우리딘이인산포도당이 되고, 글리코겐 합성효소의 작용으로 글리코겐에 흡수되어 저장된다.
식물에서도 우리딘이인산포도당을 거쳐 수크로스·녹말로서 저장된다. 식물에서의 포도당 생합성은 다음과 같다. 광합성의 명반응에서 생기는 에너지와 이산화탄소 및 물에서 트리오스가 합성되고, 이것을 바탕으로 헥소스인 포도당이 합성되어 녹말(starch)로서 저장된다.
동물에서는 간에서 옥살아세트산으로부터 포스포엔올피루브산을 생성하고, 해당 경로(glycolysis)를 거의 역행하여 재합성된다. 거의 대부분의 아미노산이 포도당으로 변환되는 경우는 이 경로를 따른다. 공업적으로는 녹말의 가수분해에 의해 얻을 수 있다. 포도당은 영양제·강장제·해독제 이외에, 감미제로도 사용된다. L-포도당은 D-포도당의 광학이성질체이며, 인공적으로 합성된다.
- C6H12O6 + 6O2 + 6H2O → 6CO2 + 12H2O + 38ATP(또는 36ATP) (40%) + 열 (60%)
광합성에서는 다음과 같은 반응으로 포도당을 생성한다.
- 6CO2 + 12H2O → C6H12O6 + 6H2O + 6O2
포도당의 연소 반응은 다음과 같다. 포도당의 연소는 400°C(673K)의 높은 온도에서 발생한다.
- C6H12O6 → 2CO2 + 2CH3CH2OH
포도당은 우리 인체에서 필수적인 원소로 탄수화물의 기반이 된다. 글리코겐은 보통 포도당 분자 6만 개로 되어 있다. 글리코겐은 녹말과 매우 닮았기 때문에 보통 동물성 녹말로도 많이 부른다.
혐기성 분해 편집
글루코스(포도당)의 혐기성 분해과정은 메탄(CH4)과 이산화탄소(CO2)를 생성한다.
- C6H12O6 → 3CH4 + 3CO2
같이 보기 편집
각주 편집
- ↑ 가 나 Boerio-Goates, Juliana (1991), “Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K”, 《J. Chem. Thermodynam.》 23 (5): 403–09, doi:10.1016/S0021-9614(05)80128-4
- ↑ Ponomarev, V. V.; Migarskaya, L. B. (1960), “Heats of combustion of some amino-acids”, 《Russ. J. Phys. Chem. (Engl. Transl.)》 34: 1182–83
