비소세포폐암
비소세포폐암(非小細胞肺癌, Non-small-cell lung cancer, NSCLC)은 소세포폐암(SCLC)을 제외한 모든 유형의 상피성 폐암을 말한다. 전체 폐암의 약 85%를 차지한다.[1][2][3] 비소세포폐암은 소세포폐암에 비해 화학요법에 상대적으로 둔감하다. 가능한 경우 주로 완치를 목적으로 수술적 절제를 통해 치료하지만, 수술 전(선행화학요법)과 수술 후(수술후보조요법) 모두에서 화학 요법이 점점 더 많이 사용되고 있다.
 | |
|---|---|
| 다른 이름 | NSCLC |
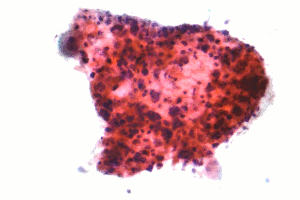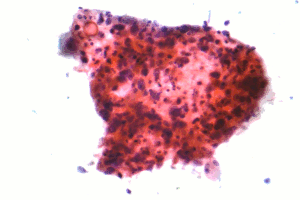 | |
| 비소세포 폐암의 일종인 편평세포상피암의 현미경 사진 | |
| 진료과 | 종양학 |
유형
편집가장 흔한 유형의 비소세포폐암은 편평상피세포암, 대세포암, 선암이며, 다른 종류의 유형은 드물게 발생한다. 이러한 유형으로는 다형성, 카르시노이드 종양, 침샘 암종, 분류되지 않은 암종 등이 있다.[5] 모든 유형은 비정상적인 조직학적 변이 및 혼합 세포 유형의 조합으로 발생할 수 있다.[6] 편평세포 암종은 비소세포 폐암의 절반 가량을 차지한다. 조직 분류에서 중앙 유형은 약 1/9 을 포함한다. 때때로 "달리 명시되지 않음"(NOS)이라는 문구는 일반적으로 보다 구체적인 진단을 내릴 수 없을 때 사용된다. 이는 병리학적으로 세포 검사 또는 생검 표본에서 일부의 악성 세포 또는 조직에 대해 사용된다.[6] 흡연 경험이 없는 사람의 폐암은 거의 대부분 비소세포폐암이며, 상당수가 선암이다.[7] 비교적 드물게 악성 폐 종양에 소세포폐암과 비소세포폐암의 성분이 모두 포함되어 있는 경우가 있다. 이러한 경우 종양은 복합 소세포 폐암(c-SCLC[8])으로 분류되며 일반적으로 SCLC에 준해 치료한다.[9]
폐 선암
편집폐 선암은 현재 "비흡연자"(평생 비흡연자)에게 가장 많이 나타나는 폐암 유형이다.[10] 선암은 폐암의 약 40%를 차지한다. 역사적으로 선암은 폐의 주변에서 더 자주 발견되었으며, 두 암 모두 폐 중심부에 더 자주 발생하는 경향이 있다. 비소세포폐암과 편평상피세포폐암보다는 선암이 더 흔하게 나타났다고 한다.[11][12] 그러나 최근 연구에 따르면 "중심에서 발생하는 병변과 말초에서 발생하는 병변의 비율"이 선암과 편평 세포 암종 모두에서 일관되게 수렴하고 있을 수 있다고 한다.
폐의 편평상피세포암
편집폐의 편평상피세포암(Small-cell carsinoma, SCC)은 여성보다 남성에게 더 자주 발생한다. 대부분의 다른 유형의 폐암보다 흡연력과 밀접한 관련이 있다. 간호사 건강 연구에 따르면, 흡연 기간이 1~20년인 흡연자와 20~30년인 흡연자에서 모두 비흡연자(평생 비흡연자)와 비교하였을 때 편평상피세포암의 상대위험도는 약 5.5로 나타났다.[13] 흡연 기간이 30~40년인 경우 상대 위험도는 약 16, 40년 이상인 경우 약 22로 증가하였다.[13]
대세포폐암
편집대세포 폐암(Large-cell lung carcinoma, LCLC)은 폐의 변형된 상피 세포에서 발생하는 미분화 악성 신생물의 이질적인 그룹이다. 과거에는 대세포 폐암이 전체 비소세포 폐암 중 약 10%를 차지하였으나, 최신 진단 기술로 인해 전형적인 대세포 폐암의 진단율이 감소하고 분화가 잘 되지 않는 편평상피세포암과 선암의 진단율이 증가하고 있는 것으로 보여진다.[14] 대세포 폐암은 종양 세포에 소세포암, 편평세포암, 선암 또는 기타 암종보다 구체적인 조직학적 유형의 폐암으로 분류할 수 있는 현미경적 특징이 없다는 점에서 사실상 배제 진단에 해당한다. 대세포 폐암은 주로 역형성 세포 크기가 더 크고, 세포질 대 핵 크기 비율이 더 높으며, "salt-and-pepper"라는 염색질 부족 등으로 소세포 폐암과 구분된다.
증상
편집비소세포폐암의 많은 증상은 다른 질병의 징후일 수 있지만, 만성적이거나 중복되는 증상은 질병의 존재를 알리는 신호일 수 있다고 알려져 있다. 일부 증상은 덜 진행된 사례를 나타내는 지표인 반면, 일부는 암이 퍼졌다는 신호일 수 있다고 한다. 덜 진행된 암의 증상으로는 만성 기침, 피가 섞인 기침, 쉰 목소리, 호흡곤란, 천명음, 흉통, 체중 감소, 식욕부진 등이 보고되었다.[15] 질병의 초기 진행과 관련된 몇 가지 다른 증상으로는 쇠약감, 매우 피곤함, 삼킴 곤란, 얼굴이나 목의 부종, 기관지염이나 폐렴과 같은 지속적이거나 반복적인 감염 등이 언급되었다.[5][15][16] 더 진행된 경우에 나타날 수 있는 징후로는 뼈 통증, 신경계 변화(두통, 쇠약, 현기증, 균형 감각 이상 및 발작), 황달 및 신체 표면 근처에 생긴 덩어리, 팬코스트 증후군으로 인한 사지 마비 및 고칼슘혈증에 의한 메스꺼움, 구토 및 변비 등을 들 수 있다고 하였다.[15][16] 암의 진전을 나타내는 다른 증상으로 호흡 곤란, 중추정맥질환과 관련된 상대정맥질환, 삼킴 곤란, 많은 점액 생성, 쇠퇴와 같은 상태로 인한 소모와 탈진 그리고 목소리 등이 있다.[16]
원인
편집흡연은 폐암의 가장 큰 위험 요인이다.[17] 담배 연기에는 6,000 개 이상의 성분이 포함되어 있으며, 이 중 다수가 DNA 손상을 유발한다[18] (흡연으로 인한 담배 관련 DNA 손상 표 참조). 다른 원인으로는 라돈, 간접흡연 노출, 석면, 크롬, 니켈, 베릴륨, 그을음 또는 타르와 같은 물질 노출, 폐암 가족력, 대기 오염 등이 있다.[19][17] 폐암 가족력이 있으면 폐암 발병 위험이 높아질 수 있으므로 유전학도 중요한 역할을 할 수 있다.[20] 또한 연구에 따르면 폐암 발병 위험 증가와 관련된 특정 염색체 영역이 밝혀졌다.[21][22] 일반적으로 DNA 손상은 암의 주요 근본 원인으로 본다.[23] 대부분의 DNA 손상은 복구할 수 있지만,[18] 담배 연기로 인해 복구되지 않고 남은 DNA 손상이 비소세포폐암의 원인일 가능성이 크다. 복구되지 않은 손상을 지나서 DNA 가 복제될 때 부정확한 전이 합성으로 인해 돌연변이가 발생할 수 있다. 또한, DNA 이중 가닥이 끊어진 부분을 복구하거나 다른 DNA 손상을 복구하는 과정에서 복구 부위가 불완전하게 제거될 경우 후성 유전자가 침묵할 수 있다.[24][25]
비소세포폐암의 DNA 복구 결핍
편집DNA 복구 결핍은 많은 형태의 암의 근원이 된다.[26] DNA 복구가 결핍되면 복구되지 않은 DNA 손상의 빈도가 증가하고 이로 인해 부정확한 전이 합성이 발생하여 돌연변이를 유발하는 경향이 있다. 또한 손상이 증가하면 불완전한 복구가 증가하여 후성유전학적 변화로 이어질 수 있다.
DNA 복구 유전자의 돌연변이가 암에서 발생하기도 하지만, DNA 복구 유전자 발현을 감소 시키거나 침묵시키는 후성유전학적 변화로 인한 DNA 복구 결핍은 암에서 훨씬 더 자주 발생한다.
DNA 복구 유전자의 후성유전적 유전자 침묵은 비소세포폐암에서 자주 발생한다. 비교적 정확한 DNA 복구 경로에서 정상적으로 기능하는 최소 9개의 DNA 복구 유전자들 중 많은 경우에 비소세포폐암에서 프로모터 과메틸화에 의해 억제된다. 부정확한 DNA 복구 경로에서 기능하는 하나의 DNA 복구 유전자, FEN1 은 비소세포폐암에서 프로모터 영역의 과메틸화가 아닌 저메틸화(프로모터 메틸화 결핍)으로 인해 증가된 수준으로 발현된다.
정확한 DNA 복구의 빈번한 결함과 부정확한 복구의 증가는 폐암 세포에서 게놈당 10 만 개 이상의 돌연변이가 발생하는 높은 수준의 돌연변이의 원인일 수 있다.
병기 결정
편집병기 결정은 치료 옵션을 결정하는 암의 진행 정도를 결정하는 공식적인 절차다.
미국 암 공동 위원회와 국제 암 연합은 비소세포폐암, 소세포폐암 및 기관지폐 악성 종양에 대해 통일된 체계를 사용하여 TNM 병기 결정을 권장한다.[27] TNM 병기에서는 종양의 크기와 림프절 및 기타 장기로의 전이 여부에 따라 암을 분류한다. 종양의 크기가 커지고 영향을 받는 부위가 넓어지면 암의 병기도 더 많이 진행된다.
비소세포폐암 병기의 여러 요소는 의사의 치료 전략에 영향을 준다.[28] 일반적으로 폐 종양 자체는 방사선 사진으로 전체 크기를 평가하고 병리학자가 현미경으로 특정 유전자 마커를 식별하거나 흉부 내 중요한 구조물(예: 기관지 또는 흉막강)에 침범이 발생하였는지 여부를 확인하기 위해 검사한다. 다음으로, 종격동이라고 하는 흉강 내 환자의 인근 림프절에 질병이 침범하였는지 확인한다. 마지막으로, 가장 일반적으로 뇌 영상 및 뼈 스캔을 통해 전이성 질환의 더 멀리 있는 부위에 대해 환자를 검사한다.[29]
5년 생존율
편집1기부터 4기까지의 생존율은 질병의 진행으로 인해 크게 감소한다. 1기의 경우 5년 생존율은 47%, 2기는 30%, 3기는 10%, 4기는 1%이다.[30]
치료
편집암의 병기, 개인의 전반적인 건강 상태, 나이, 화학 요법에 대한 반응 및 치료의 부작용 가능성과 같은 기타 요인에 따라 한 가지 이상의 치료법이 사용되는 경우가 많다. 전체 병기 결정 후, 비소세포폐암 환자는 일반적으로 초기 비전이성 질환 환자(병기 1, 2 기 및 일부 3 형 종양), 흉강에 국한된 국소 진행성 질환 환자(예: 큰 종양, 중요한 흉부 구조와 관련된 종양, 종격동 림프절 양성 환자), 흉강 외부로 원격 전이된 환자 등 세 가지 범주 중 하나로 분류할 수 있다.
초기/비전이성 비소세포폐암
편집비소세포폐암은 일반적으로 화학 요법 및 방사선에 그다지 민감하지 않으므로[31] 환자가 조기에 진단되면 수술(종양 제거를 위한 폐 절제술)이 여전히 선택되는 치료법이다.[32]
작지만 수술이 불가능한 종양이 있는 경우 고도로 표적화된 고강도 방사선 치료를 받을 수 있다. 새로운 방사선 치료 방법을 통해 의사는 폐암을 더 정확하게 치료할 수 있다. 이는 방사선이 주변의 건강한 조직에 미치는 영향이 적다는 것을 의미한다. 새로운 방법에는 사이버나이프와 정위적 체부 방사선 치료가 포함된다. 고위험군으로 간주되는 특정 환자는 초기 수술 또는 방사선 치료 후 보조(보조) 화학 요법을 받을 수도 있다. 여러 가지 가능한 화학 요법을 선택할 수 있지만 대부분은 시스플라틴이라는 백금 기반이 들어간 화학 요법 약물들 중 하나를 포함한다.
다른 치료법으로는 경피적 절제술과 화학색전술이 있다.[33] 폐암에 가장 널리 사용되는 절제술은 고주파 절제술(RFA), 냉동 절제술, 마이크로파 절제술이다.[34] 종양이 폐의 바깥쪽 가장자리 근처에 있는 환자에게는 절제술이 옵션으로 제시될 수 있다. 기관, 주요 기관지, 식도 및 중심 혈관에서 1cm 미만의 결절은 합병증 위험이 높고 불완전 절제가 빈번하므로 고주파 절제술에서 제외해야 한다. 또한 5cm 이상의 병변은 제외해야 하며, 3~5cm 병변은 재발 위험이 높으므로 신중하게 고려해야 한다.[35] 최소 침습 시술은 동반 질환이나 제한된 폐 기능으로 인해 수술에 적합하지 않은 환자에게 더 안전한 대안이 될 수 있다. 고령자의 초기 비소세포폐암 치료로 열 절제술과 폐엽하 절제술을 비교한 연구에 따르면 환자의 전체 생존율에 차이가 없는 것으로 나타났다.[36] 고주파 열절제술과 방사선 치료는 두 가지 세포 파괴 메커니즘의 시너지 효과로 인해 생존율에 이점이 있을 수 있다.[37]
진행성/전이성 비소세포폐암
편집진행성 비소세포폐암 환자의 치료는 우선 통증과 고통을 완화하는 데 목적이 있으나(완화), 다양한 화학요법 옵션들이 있다.[38][39] 이러한 약제에는 빠르게 분열하는 모든 세포를 무차별적으로 표적으로 삼는 시스플라틴과 같은 전통적인 화학 요법과 종양 내에서 발견되는 특정 유전적 이상에 더 맞춤화된 새로운 표적 약제가 모두 포함된다.[39] 적절한 화학 요법을 선택할 때는 독성 프로필(약물의 부작용)을 고려하고 환자의 동반 질환(환자가 겪고 있는 다른 질환 또는 부작용)과 균형을 맞춰야 한다. 카보플라틴은 시스플라틴과 비교하여 환자의 생존에 유사한 영향을 주는 화학 요법제이며 시스플라인과 다른 독성 프로필을 가지고 있다. 카보플라틴은 혈소판 감소증의 위해가 덜 높을 수 있다. 시스플라틴은 카보플라틴 치료와 비교하여 메스꺼움이나 구역질등을 덜 유발할 수 있다.[39] PD-L1 억제제는 백금 기반 화학요법에 비해 효과가 더 좋으며, 부작용도 적고 생존기간도 길어질 수 있다.[40]
현재 비소세포폐암 종양에서는 표피 성장 인자(EGFR)와 역형성 림프종 키나아제 내 돌연변이라는 두 가지 유전자 마커가 치료 결정에 도움을 주기 위해 일상적으로 검사되고 있다.[41] 또한, 비소세포폐암에서 돌연변이가 발생하여 향후 치료에 영향을 미칠 수 있는 것으로 알려진 유전자 마커는 BRAF, HER2/neu, KRAS 등 여러 가지가 추가로 있다. 진행성 비소세포폐암의 경우, EGFR 신호 경로를 표적으로 하는 항체인 세툭시맙을 포함한 복합 화학요법 치료 접근법이 표준 화학요법 단독 요법에 비해 환자의 전반적인 생존율을 개선하는 데 더 효과적이다.[42]
열 절제술(예: 고주파 열절제술, 냉동 절제술, 마이크로파 절제술)은 종양 관련 증상이나 치료 부위 내 재발의 완화 치료에 적합하다. 기대 수명이 1년미만인 중증 폐섬유증 및 중증 폐기종 환자는 이 치료의 부적합한 후보로 간주해야 한다.[34]
EGFR 돌연변이
편집비소세포폐암 환자의 약 10~35%는 EGFR 의 약물 민감성 돌연변이를 가지고 있다.[41] 이러한 돌연변이의 분포는 인종에 따라 달라지는 것으로 밝혀졌으며, 한 연구에 따르면 백인의 경우 10%, 아시아인의 경우 50%가 이러한 종양 마커를 가지고 있는 것으로 추정된다.[43] 다양한 EGFR 돌연변이가 발견되었지만 특정 이상은 단백질의 과활성 형태를 초래한다. 이러한 돌연변이가 있는 사람은 조직학적으로 선암을 가진 비흡연자 또는 가벼운 흡연자일 가능성이 더 높다. 이러한 사람들은 특히 티로신 키나제 억제제, 엘로티닙, 게프티닙, 아파티닙 또는 오시머티닙으로 알려진 EGFR 단백질을 차단하는 특정 약물에 민감하게 반응하는 것으로 나타났다.[44] 진단 기술의 민감도가 다양하기 때문에 폐암의 돌연변이를 확실하게 식별하려면 신중한 고려가 필요하다.[45]
ALK 유전자 재배열
편집비소세포폐암 환자의 최대 7%는 ROS1 유전자에 EML4-ALK 전위 또는 돌연변이가 있으며, 이러한 환자들은 ALK 억제제 치료를 받을 수 있다.[46] 2011년 8월 FDA 승인을 받은 크리조티닙은 여러 키나아제, 특히 ALK, ROS1, MET를 억제하는 약제다.[32] 크리조티닙은 임상 연구에서 ALK 양성 질환이 있는 환자에서 약 60% 의 반응률을 보이는 것으로 나타났다. 또한 여러 연구에 따르면 ALK 돌연변이와 EGFR 활성화 돌연변이는 일반적으로 상호 배타적인 것으로 나타났다. 따라서 크리조티닙 치료에 실패한 환자는 엘로티닙과 같은 EGFR 표적 치료제로 전환하는 것이 권장되지 않는다.[32]
다른 치료 방법
편집EGFR 또는 ALK 돌연변이가 발견되지 않은 진행성 비소세포폐암 환자는 혈관 내피 성장 인자(VEGF)를 표적으로 하는 단일 클론 항체 약물인 베바시주맙을 투여할 수 있다. 이는 특정 재발성 또는 진행성 비소세포폐암(병기 IIIB 또는 IV) 환자에게 카보플라틴 및 파클리탁셀 화학요법에 베바시주맙을 추가하면 전체 생존율과 무진행 생존율을 모두 높일 수 있다는 동부 협력 종양학 그룹 연구에 근거한 것이다.[47]
프로그램된 사멸 리간드 1(PD-L1)을 발현하는 비소세포 폐암(NSCLC) 세포는 T 세포 표면에 발현된 프로그램된 사멸 수용체 1(PD-1)과 상호작용하여 면역체계에 의한 종양 세포 사멸을 감소시켜 준다. 아테올리주맙은 항 PD-L1 단일 클론 항체다. 니볼루맙과 펨브롤리주맙은 항 PD-1 단일클론 항체다. 이필리무맙은 T 세포 표면의 세초 독성 T 림프구 관련 단백질4(CTLA-4)를 표적으로 하는 단일 클론 항체이다. 베바시주맙은 순환계의 혈관내피세포생장인자(VEGF)를 표적으로 하는 단일클론항체로 혈관신생 억제제 역할을 한다. 면역항암제를 비소세포폐암의 1차 치료제로 사용하는 여러 3상 임상시험이 발표되었는데, 펨브롤리주맙은 KEYNOTE-024, KEYNOTE-042, KEYNOTE-189, KEYNOTE-407에서, 니볼루맙과 이필리무맙은 CHECKMATE227, CHECKMATE 9LA에서, 아테졸리주맙은 IMpower110, IMpower130, IMpower150에서 연구되었다.
2015년 미국 식품의약국(FDA)은 진행성 또는 전이성 SCC에 대한 항 PD-1 제제 니볼루맙을 승인하였다. 2015년에 FDA는 전이성 SCC에 대한 항 EGFR 약물 네시투무맙도 승인하였다. 2015년 10월 2일, FDA는 종양이 PD-L1을 발현하고 다른 화학요법제 치료에 실패한 환자의 전이성 비소세포폐암 치료를 위해 펨브롤리주맙을 승인하였다.
2016년 10월, 펨브롤리주맙은 암이 PDL1을 과발현하고 암에 EGFR 또는 ALK 돌연변이가 없는 경우 비소세포폐암 치료에 1차로 사용되는 최초의 면역 요법이 되었으며, 이미 화학 요법을 시행한 경우 펨브롤리주맙을 2차 치료제로 사용할 수 있지만 암에 EGFR 또는 ALK 돌연변이가 있는 경우 해당 돌연변이를 표적하는 약제를 먼저 사용해야 한다. PDL1의 평가는 검증되고 승인된 동반 진단을 통해 수행되어야 한다.
진행성 또는 전이성 질환에 대한 1차 치료에서 면역 요법을 통합한 프로토콜로 치료받은 비소세포 폐암 환자의 전체 생존율은 Nasser NJ, 고렌버그 M, 아그바리야 A 등의 연구에서 보고되었다.
비소세포 폐암 환자의 예후는 면역 요법의 도입으로 크게 개선되었다. 종양 PDL-1 이 종양 세포의 절반이상에서 발현된 환자들은 펨브롤리주맙을 투여하여 전체 생존기간 중앙값이 30개월까지 증가하였다.[48][49]
모보세르티닙(성분명: 엑스키티닙)은 2021년 9월 미국에서 의료용으로 승인되었으며, 백금 기반 화학요법 중 또는 이후에 질병이 진행된 표피 성장 인자 수용체(EGFR) 엑손 20 삽입 변이가 있는 국소 진행성 또는 전이성 비소세포 폐암(NSCLC) 성인 환자에서 치료제로 사용할 수 있다.[50][51]
각주
편집- ↑ Khajuria, Ocean; Sharma, Neha (2021년 12월 1일). “Epigenetic targeting for lung cancer treatment via CRISPR/Cas9 technology”. 《Advances in Cancer Biology - Metastasis》 (영어) 3: 100012. doi:10.1016/j.adcanc.2021.100012. ISSN 2667-3940. S2CID 241848193.
- ↑ Non-Small Cell Lung Cancer - eMedicine
- ↑ “What Is Non-Small Cell Lung Cancer?”. 《www.cancer.org》. 2017년 1월 17일에 원본 문서에서 보존된 문서. 2023년 9월 13일에 확인함.
- ↑ Smokers defined as current or former smoker of more than 1 year of duration. See image page in Commons for percentages in numbers. Reference: Table 2 in: Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (June 2008). “Comparison of aspects of smoking among the four histological types of lung cancer”. 《Tobacco Control》 17 (3): 198–204. doi:10.1136/tc.2007.022582. PMC 3044470. PMID 18390646.
- ↑ 가 나 “Non-Small Cell Lung Cancer Treatment”. 《National Cancer Institute》 (영어). 1980년 1월 1일. 2017년 12월 4일에 확인함.
- ↑ 가 나 “Non-small cell lung cancer treatment – National Cancer Institute”. 1980년 1월 1일. 2008년 10월 19일에 확인함.
- ↑ Hanna N (2007). “Lung Cancer in the Never Smoker Population”. 《Hematology-Oncology》. Medscape.
- ↑ Travis, William D; Brambilla, Elisabeth; Muller-Hermelink, H Konrad; 외., 편집. (2004). 《Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart》 (PDF). World Health Organization Classification of Tumours. Lyon: IARC Press. ISBN 978-92-832-2418-1. 2009년 8월 23일에 원본 문서 (PDF)에서 보존된 문서. 2010년 3월 27일에 확인함.
- ↑ Simon GR, Turrisi A (September 2007). “Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)”. 《Chest》 132 (3 Suppl): 324S–339S. doi:10.1378/chest.07-1385. PMID 17873178. 2013년 1월 12일에 원본 문서에서 보존된 문서.
- ↑ Subramanian J, Govindan R (February 2007). “Lung cancer in never smokers: a review”. 《Journal of Clinical Oncology》 25 (5): 561–70. doi:10.1200/JCO.2006.06.8015. PMID 17290066.
- ↑ Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). 〈morphology of adenocarcinoma〉. 《Robbins Basic Pathology》 8판. Philadelphia: Saunders. ISBN 978-1-4160-2973-1.
- ↑ Travis WD, Travis LB, Devesa SS (January 1995). “Lung cancer”. 《Cancer》 75 (1 Suppl): 191–202. doi:10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y. PMID 8000996. S2CID 221577784.
- ↑ 가 나 Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (June 2008). “Comparison of aspects of smoking among the four histological types of lung cancer”. 《Tobacco Control》 17 (3): 198–204. doi:10.1136/tc.2007.022582. PMC 3044470. PMID 18390646.
- ↑ Popper HH (2011). “Large cell carcinoma of the lung – a vanishing entity?”. 《Memo - Magazine of European Medical Oncology》 4: 4–9. doi:10.1007/s12254-011-0245-8. S2CID 71238993.
- ↑ 가 나 다 “Non-Small Cell Lung Cancer Signs and Symptoms”. 《www.cancer.org》. 2017년 12월 4일에 확인함.
- ↑ 가 나 다 “Non-small cell lung cancer”. 《University of Maryland Medical Center》 (영어). 2017년 12월 4일에 확인함.
- ↑ 가 나 “Non-Small Cell Lung Cancer Risk Factors”. 《www.cancer.org》. 2016년 12월 7일에 원본 문서에서 보존된 문서. 2023년 9월 13일에 확인함.
- ↑ 가 나 Liu X, Conner H, Kobayashi T, Kim H, Wen F, Abe S, 외. (August 2005). “Cigarette smoke extract induces DNA damage but not apoptosis in human bronchial epithelial cells”. 《American Journal of Respiratory Cell and Molecular Biology》 33 (2): 121–9. doi:10.1165/rcmb.2003-0341OC. PMID 15845867.
- ↑ “Non-Small Cell Lung Cancer Treatment”. 《National Cancer Institute》 (영어). 1980년 1월 1일. 2017년 12월 4일에 확인함.
- ↑ Khajuria, Ocean; Sharma, Neha (2021년 12월 1일). “Epigenetic targeting for lung cancer treatment via CRISPR/Cas9 technology”. 《Advances in Cancer Biology - Metastasis》 (영어) 3: 100012. doi:10.1016/j.adcanc.2021.100012. ISSN 2667-3940. S2CID 241848193.
- ↑ Khajuria, Ocean; Sharma, Neha (2021년 12월 1일). “Epigenetic targeting for lung cancer treatment via CRISPR/Cas9 technology”. 《Advances in Cancer Biology - Metastasis》 (영어) 3: 100012. doi:10.1016/j.adcanc.2021.100012. ISSN 2667-3940. S2CID 241848193.
- ↑ Herbst, Roy S.; Heymach, John V.; Lippman, Scott M. (2008년 9월 25일). “Lung Cancer”. 《New England Journal of Medicine》 359 (13): 1367–1380. doi:10.1056/NEJMra0802714. ISSN 0028-4793. PMID 18815398. S2CID 33554415.
- ↑ Kastan MB (April 2008). “DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture”. 《Molecular Cancer Research》 6 (4): 517–24. doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
- ↑ O'Hagan HM, Mohammad HP, Baylin SB (August 2008). Lee JT, 편집. “Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island”. 《PLOS Genetics》 4 (8): e1000155. doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
- ↑ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, 외. (July 2007). “DNA damage, homology-directed repair, and DNA methylation”. 《PLOS Genetics》 3 (7): e110. doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
- ↑ Harper JW, Elledge SJ (December 2007). “The DNA damage response: ten years after”. 《Molecular Cell》 28 (5): 739–45. doi:10.1016/j.molcel.2007.11.015. PMID 18082599.
- ↑ 〈Cancer Staging Posters: Lung〉 (PDF). 《AJCC Cancer Staging》 7판. 2009. 2011년 9월 28일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ “National Cancer Institute Non-Small Cell Lung Cancer Treatment (PDQ)”. 1980년 1월 1일. 2015년 5월 12일에 확인함.
- ↑ Chawla M, Kumar R, Agarwala S, Bakhshi S, Gupta DK, Malhotra A (October 2010). “Role of positron emission tomography-computed tomography in staging and early chemotherapy response evaluation in children with neuroblastoma”. 《Indian Journal of Nuclear Medicine》 25 (4): 147–55. doi:10.4103/0972-3919.78249. PMC 3109821. PMID 21713223.
- ↑ “Non-Small Cell Lung Cancer Survival Rates, by Stage”. 《www.cancer.org》. 2017년 12월 4일에 확인함.
- ↑ Cotran RS, Kumar V, Fausto N, Robbins SL, Abbas AK (2005). 《Robbins and Cotran pathologic basis of disease》. St. Louis MO: Elsevier Saunders. 759쪽. ISBN 978-0-7216-0187-8.
- ↑ 가 나 다 “NCCN Clinical Practice Guidelines for NSCLC” (PDF). 2015년 5월 12일에 확인함.
- ↑ “Chemoembolisation”. Cancer Research UK. 2017년 8월 30일. 2007년 10월 9일에 원본 문서에서 보존된 문서.
- ↑ 가 나 Dupuy DE, Shulman M (September 2010). “Current status of thermal ablation treatments for lung malignancies”. 《Seminars in Interventional Radiology》 27 (3): 268–75. doi:10.1055/s-0030-1261785. PMC 3324195. PMID 22550366.
- ↑ Bargellini I, Bozzi E, Cioni R, Parentini B, Bartolozzi C (October 2011). “Radiofrequency ablation of lung tumours”. 《Insights into Imaging》 2 (5): 567–576. doi:10.1007/s13244-011-0110-7. PMC 3259330. PMID 22347976.
- ↑ Kwan SW, Mortell KE, Talenfeld AD, Brunner MC (January 2014). “Thermal ablation matches sublobar resection outcomes in older patients with early-stage non-small cell lung cancer”. 《Journal of Vascular and Interventional Radiology》 25 (1): 1–9.e1. doi:10.1016/j.jvir.2013.10.018. PMID 24365502.
- ↑ Grieco CA, Simon CJ, Mayo-Smith WW, DiPetrillo TA, Ready NE, Dupuy DE (July 2006). “Percutaneous image-guided thermal ablation and radiation therapy: outcomes of combined treatment for 41 patients with inoperable stage I/II non-small-cell lung cancer”. 《Journal of Vascular and Interventional Radiology》 17 (7): 1117–24. doi:10.1097/01.RVI.0000228373.58498.6E. PMID 16868164.
- ↑ “Lung Cancer online”. 《lungcanceronline.org》. 2008년 6월 17일에 원본 문서에서 보존된 문서. 2008년 12월 13일에 확인함.
- ↑ 가 나 다 Vasconcellos, Vitor F.; Marta, Guilherme N.; da Silva, Edina Mk; Gois, Aecio Ft; de Castria, Tiago B.; Riera, Rachel (2020년 1월 13일). “Cisplatin versus carboplatin in combination with third-generation drugs for advanced non-small cell lung cancer”. 《The Cochrane Database of Systematic Reviews》 1 (1): CD009256. doi:10.1002/14651858.CD009256.pub3. ISSN 1469-493X. PMC 6956680. PMID 31930743.
- ↑ Ferrara, Roberto; Imbimbo, Martina; Malouf, Reem; Paget-Bailly, Sophie; Calais, François; Marchal, Corynne; Westeel, Virginie (2021년 4월 30일). “Single or combined immune checkpoint inhibitors compared to first-line platinum-based chemotherapy with or without bevacizumab for people with advanced non-small cell lung cancer”. 《Cochrane Database of Systematic Reviews》 2021 (4): CD013257. doi:10.1002/14651858.CD013257.pub3. PMC 8092423. PMID 33930176.
- ↑ 가 나 “Molecular Profiling of Lung Cancer”. 2015년 5월 12일에 확인함.
- ↑ Yang ZY, Liu L, Mao C, Wu XY, Huang YF, Hu XF, Tang JL (November 2014). “Chemotherapy with cetuximab versus chemotherapy alone for chemotherapy-naive advanced non-small cell lung cancer”. 《The Cochrane Database of Systematic Reviews》 (11): CD009948. doi:10.1002/14651858.CD009948.pub2. PMID 25400254.
- ↑ Hirsch FR, Bunn PA (May 2009). “EGFR testing in lung cancer is ready for prime time”. 《The Lancet. Oncology》 10 (5): 432–3. doi:10.1016/s1470-2045(09)70110-x. PMID 19410185.
- ↑ Kris MG (October 2005). “How today's developments in the treatment of non-small cell lung cancer will change tomorrow's standards of care”. 《The Oncologist》. 10 Suppl 2 (Suppl 2): 23–9. doi:10.1634/theoncologist.10-90002-23. PMID 16272456.
- ↑ Sherwood J, Dearden S, Ratcliffe M, Walker J (September 2015). “Mutation status concordance between primary lesions and metastatic sites of advanced non-small-cell lung cancer and the impact of mutation testing methodologies: a literature review”. 《Journal of Experimental & Clinical Cancer Research》 34 (1): 92. doi:10.1186/s13046-015-0207-9. PMC 4559261. PMID 26338018.
- ↑ Farmer (2010). “Non-Small-Cell Lung Cancer Standards of Care Challenged by a Cornucopia of New Drugs”.
- ↑ Sandler A, Gray R, Perry MC, Brahmer J, Schiller JH, Dowlati A, 외. (December 2006). “Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer”. 《The New England Journal of Medicine》 355 (24): 2542–50. doi:10.1056/nejmoa061884. PMID 17167137.
- ↑ Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, 외. (November 2016). “Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer”. 《The New England Journal of Medicine》 375 (19): 1823–1833. doi:10.1056/NEJMoa1606774. PMID 27718847.
- ↑ Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, 외. (March 2019). “Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater”. 《Journal of Clinical Oncology》 37 (7): 537–546. doi:10.1200/JCO.18.00149. PMID 30620668. S2CID 58640902.
- ↑ “FDA grants accelerated approval to mobocertinib for metastatic non-sma”. 《U.S. Food and Drug Administration (FDA)》. 2021년 9월 16일. 2021년 9월 16일에 확인함. 이 문서는 퍼블릭 도메인 출처의 본문을 포함합니다.
- ↑ “Takeda's Exkivity (mobocertinib) Approved by U.S. FDA as the First Oral Therapy Specifically Designed for Patients with EGFR Exon20 Insertion+ NSCLC” (보도 자료). Takeda. 2021년 9월 15일. 2021년 9월 16일에 확인함 – Business Wire 경유.