탈염과 완충액 교환
탈염 및 완충액 교환(Desalting and buffer exchange)은 용해성 거대 분자를 보다 작은 분자에서 분리(탈염)하거나 이후의 사용에 적합한 상태로 완충액을 교환하는 방법이다.[1] 이러한 방법은 겔 여과 크로마토그래피 원리에 기반하며,[2] 분자체 크로마토 그래피, 크기 배제 크로마토그래피(size-exclusion chromatography). 탈염 및 완충액 교환은 가장 일반적인 겔 여과 크로마토그래피의 활용법 중 두 가지이며 동일한 레진을 사용하여 수행할 수 있다.
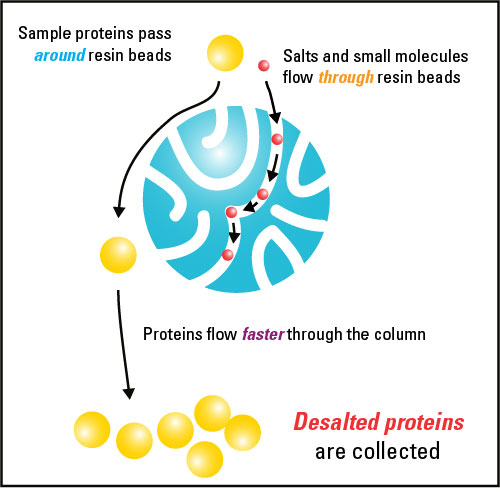
탈염 및 완충액 교환은 작은 다공성 중합체 비드 (수지)를 사전 평형화하기 위해 사용되는 완충액에서 시료의 성분을 회수하는 것을 수반한다. 탈염은 물과 교환 할 때 완충 염 및 다른 작은 분자가 시료에서 제거 될 때 발생힐다 (수지가 물에서 사전 평형 됨). 완충액 교환은 시료의 완충액을 다른 완충액의 완충액과 교환 할 때 발생한다.
응용
편집탈염은 단백질 용액, 페놀 또는 결합되지 않은 핵산에서 뉴클레오티드 또는 과도한 결합 또는 접합된 단백질의 표지 시약으로부터 염을 제거하는데 사용한다. 버퍼 교환은 단백질 용액을 이온 교환, 전기 영동 또는 친화성 크로마토 그래피 와 같은 후속 응용 실험에 적합한 버퍼 시스템으로 전달하는데 사용한다.
탈염 및 버퍼 교환의 원리
편집크기면에서 미묘한 차이를 기반으로 거대 분자를 분리하기위한 크기 배제 크로마토 그래피 응용법은 일반적으로 긴 크로마토 그래피 컬럼에서 크고 다양한 기공 크기를 갖는 레진(resin)을 사용한다. 그러나 완충액 교환 및 탈염 용도의 경우 분리 할 수 있는 분자의 크기를 결정하는 것은 주로 최대 유효 공극 크기 (배제 한계 또는 수지의 분자량 컷오프 (MWCO))이다. MWCO보다 큰 분자는 수지의 기공 안으로 침투하지만 MWCO보다 큰 분자는 기공에 들어가서 기둥의 무효 부피에 함께 남아있게된다. 샘플을 충분한 길이와 부피의 컬럼 수지 베드를 통과시킴으로써, 거대 분자는 레진 베드의 기공을 통해 더 멀리 떨어진 작은 분자로부터 완전히 분리 될 수 있다. 배제 한계보다 큰 분자의 현저한 분리는 발생하지 않는다.
원하는 거대 분자가 공극 부피 내에 잔류하기 위해서는 매우 작은 공극 크기의 수지를 사용해야 한다. 전형적인 탈염 및 완충액 교환의 경우 분자량이 5KDa와 10KDa 사이인 레진을 선택하는 것이 가장 좋다. 전체 크기(full-sized)의 단백질에서 펩티드를 분리하는 것과 같은 다른 용도의 경우, 더 큰 배제 한계가있는 레진이 필요할 수 있다. 거대 분자 성분은 겔 여과 기질을 미리 평형화 시키는데 사용되는 완충액에서 회수되는 반면, 소분자는 보다 적은 분량의 부피로 수집되거나 레진에 갇히게된다. 레진을 선택할 때 주의해야 할 중요한 특징 중 하나는 제거하고자하는 작은 분자가 적절한 분리를 위해 MWCO보다 몇 배 작아야 한다는 것이다.
탈염 및 완충액 교환과 투석의 비교
편집투석은 겔 여과 크로마토 그래피로 수행되는 동일한 탈염 및 완충액 교환 응용에 유용하며, 두 방법 모두 유사한 분자량 차단 한계에 근거한다. 겔 여과는 투석에 비해 상대적으로 적은 양의 시료에서 오염 물질을 제거할 수 있는 능력과 함께 유독성 또는 방사성 물질로 작업 할 때 중요한 기능인 속도의 이점을 가지고 있다(투석의 경우 몇 분 대 시간). 반면에 투석은 장치 형식과 관련하여 표본 크기에 크게 의존하지 않는다. 투석 적용법의 경우, 높은 비율의 샘플 회수 및 분자 제거를 달성하는 것이 거의 최적화되지 않은 상태에서 일반적으로 간단하다. 겔 여과 용도의 경우 시료에 적합한 컬럼 크기와 형식을 선택하는 것이 중요하다.
작은 시료 처리를 위한 겔 여과 형식
편집작은 (4mL 미만의) 부피에 대해 겔 여과를 수행하기위한 여러 가지 일반적인 방식이 있다.
- 크로마토 그래피 컬럼
- 중력 흐름 컬럼
- 크로마토 그래피 카트리지
- 컬럼 원심 분리기
- 원심 분리기 플레이트
중력 흐름, 또는 드립방식, 칼럼은 버퍼 체이스의 두부 압력을 사용하여 시료를 겔 여과 매트릭스에 밀어 넣는다. 샘플을 직립 기둥의 상단에 넣고 레진 베드로 흘려 보낸다. 그런 다음 샘플을 컬럼 상단에 추가 완충액 또는 물을 추가하여 컬럼을 따라 쫓아낸다. 이 과정에서 작은 분획이 일반적으로 수집되고 각각의 관심있는 거대 분자가 시험된다. 경우에 따라 여러 분획에 단백질이 포함될 수 있으며 수율을 높이기 위해 풀을 사용해야 할 수도 있다. 드립 컬럼으로 분류된 시간 및 모니터링을 제거하기 위해, 컬럼의 전체 무효 부피와 동일한 분율이 샘플 용량에 관계없이 수집되어 샘플의 현저한 희석을 초래한다.
밀폐된 크로마토 그래피 카트리지 또는 컬럼은 액체 크로마토 그래피 (LC) 시스템과 같은 외부 장치에 의해 시료 및 완충액이 수지로 펌핑되는 것을 제외하고는 유사하게 작동하며 여러 분획의 수집 및 모니터링이 필요하다. 이 방법은 종종 반자동이기는하지만 크로마토 그래피 카트리지를 사용하는 것은 대개 한 번에 한 샘플을 처리하는 것으로 제한되며, 체이스 버퍼에서 일부 샘플 희석이 여전히 발생할 수 있다.
시료 희석 및 분획의 수집 및 모니터링을 제거하기 위해 원심 분리 컬럼 또는 플레이트 탈염 (spin desalting)이라고도하는 플레이트 기반 겔 여과법이 일반적으로 사용된다. 스핀 탈염은 원심 분리기를 사용하여 수지에서 액체의 공극 체적을 먼저 제거한 다음 시료를 첨가하고 원심 분리하여 수행한다는 점에서 독특하다다. 원심 분리 후 시료의 거대 분자는 거의 동일한 초기 부피로 컬럼을 통과하지만 작은 분자는 레진의 기공으로 들어가고 겔 여과 매트릭스를 사전 평형화하는 데 사용된 완충액으로 교체된다. 스핀 컬럼과 플레이트는 중력 흐름에 의해 시료가 출현 할 때까지 기다릴 필요가 없으므로 다중 시료 처리를 동시에 허용하는 크로마토 그래피 시스템이 필요하지 않다.
탈염 및 완충액 교환 칼럼 및 플레이트 공급 업체
편집탈염 스핀 컬럼은 다양한 부피 및 MWCO 한도 안에서 널리 이용 가능하다 :
외부 자원
편집각주
편집- ↑ Porath, J; Flodin P (1959년 6월 13일). “, Gel Filtration: A method for desalting and group separation”. 《Nature》 183: 1657–1659. doi:10.1038/1831657a0. PMID 13666849.
- ↑ Hagel, L (May 2001). “Gel-filtration chromatography”. 《Curr Protoc Mol Biol》. Chapter 10: Unit 10.9. doi:10.1002/0471142727.mb1009s44. PMID 18265066.