시냅스 소포
시냅스 소포(영어: synaptic vesicle) 또는 신경전달물질 소낭(神經傳達物質 小囊)은 뉴런에서 다양한 신경전달물질을 저장하고 방출한다. 신경전달물질의 방출은 전압 개폐 칼슘 채널이 조절한다. 소포는 뉴런 간에 활동전위를 전달하는데 중요한 요소이며, 뉴런에 의해 계속해서 재생산된다. 축삭에서 소포가 모여있는 부분을 축삭 말단이라고 한다. 0.2 Hz의 자극이 10분 간 지속되는 동안 한 축삭 말단에서 최대 130여 개의 소포가 방출될 수 있다.[1] 사람의 1차 시각피질(V1)에 있는 시냅스 소포는 평균 지름 39.5 nm이다.[2]
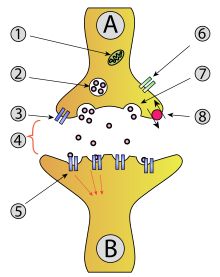
1: 미토콘드리아
2: 신경전달물질이 있는 시냅스 소포
3: 자가수용체
4: 신경전달물질이 방출된 시냅스
5: 신경전달물질에 의하여 활성화된 시냅스후 수용체. 시냅스후 전위가 유도된다.
6: 칼슘 채널
7: 소포의 세포외유출
8: 신경전달물질은 재흡수되기도 한다.
조성
편집시냅스 소포는 상대적으로 단순하다. 제한된 개수의 단백질만이 지름 40 nm의 구형 소포에 들어갈 수 있기 때문이다. 정제된 소포는 단백질:인지질 비율이 1:3으로, 지질의 조성은 포스파티딜콜린 40%, 포스파티딜에탄올아민 32%, 포스파티딜세린 12%, 포스파티딜이노시톨 5%, 그리고 콜레스테롤 10%로 이루어진다.[4]
시냅스 소포에는 필수적인 요소가 두 가지 있다. 수송 단백질(transport protein)은 신경전달물질 재흡수에 관여하는 요소이고, 이동 단백질(trafficking protein)은 시냅스 소포의 세포외유출, 세포내이입, 재활용에 관여하는 요소이다.
- 수송 단백질은 전기화학적 기울기를 만들어 신경전달물질 흡수가 가능하도록 하는 양성자 펌프와 실제로 신경전달물질 흡수를 조절하는 신경전달물질 수송체로 이루어진다. V-ATP효소(V-ATPase)가 ATP를 분해하여 얻은 에너지로 양성자 기울기를 생성한다. 소포 수송체는 신경전달물질을 세포질에서 시냅스 소포 안으로 옮긴다. 예를 들어 소포 글루탐산 수송체(VGluT)는 글루탐산을 소포에 저장한다.
- 이동 단백질은 더 복잡하다. 이동 단백질에는 내재막단백질, 주변결합단백질, en:SNARE 등 단백질이 포함되어 있다. 이 단백질들은 시냅스 소포 단백질로 묶을 수 있을 만한 공통적인 특징을 가지고 있지는 않고, 어떻게 시냅스 소포에 특이적으로 위치하는지는 알려진 것이 거의 없다. 전부는 아니지만 많은 시냅스 소포 단백질이 비(非)소포성 단백질과 상호작용하며 특정한 기능이 할당된다.[4]
각 신경전달물질이 소포로 이동하는 데에 따른 화학량론이 아래에 제시되어 있다.
신경전달물질 유형 소포 내로 이동 소포 밖으로 이동 노르에피네프린, 도파민, 히스타민, 세로토닌, 아세틸콜린 신경전달물질+ 2 H+ GABA와 글라이신 신경전달물질 1 H+ 글루탐산 신경전달물질– + Cl– 1 H+
신경독소의 영향
편집신경독소 중 바트라코톡신 등은 시냅스 소포를 파괴하는 것으로 알려져 있다. 파상풍 독소는 v-SNARE의 일종인 소포연관 막 단백질(VAMP)을 손상시키고, 보툴리눔 독소는 t-SNARE와 v-SNARE를 손상시켜 시냅스 전달을 저해한다.[5] α-라트로톡신이라는 거미 독은 뉴렉신(neurexin)에 결합하여 소포를 손상시키고 신경전달물질이 다량 방출되게 한다.
소포 유형
편집축삭말단에 있는 소포는 세 가지 유형(pool)으로 나눌 수 있다. 바로 방출될 수 있는 유형과 재이용 유형, 예비 유형이 그것이다.[6] 각 유형은 기능과 신경 말단에서 위치하는 곳에 따라 구분한다. 바로 방출될 수 있는 유형은 세포막에 붙어 자극이 오면 가장 먼저 방출되는 집단이다. 이 유형은 적으며, 빠르게 고갈된다. 재이용 유형은 세포막에 가까이 있고, 적당한 자극에 반응하여 소포의 형성 속도와 같거나 낮은 속도로 방출된다. 이 유형은 바로 방출될 수 있는 유형보다 많고 방출되는 데에 더 오래 걸린다. 신경 말단에 있는 소포 대부분은 예비 유형에 해당하지만, 정상적으로 이 유형의 소포가 어떻게 방출되는지는 불분명하다. 실험적으로는 강한 자극에 따라 움직이고, 다른 두 유형이 고갈되었을 때에만 방출되는 것으로 보인다.[6]
주기
편집시냅스 소포가 거치는 과정은 아래와 같다.[7]
- 시냅스로 이동: 시냅스 소포는 키네신 운동단백질족을 이용하여 시냅스로 이동한다. 예쁜꼬마선충에서 시냅스 소포를 이동시키는 주요 운동단백질은 UNC-104이다.[8] 그 밖에 UNC-16/Sunday Driver 등 단백질도 시냅스 소포를 수송하는 운동단백질을 조절한다.[9]
- 신경전달물질 싣기: 시냅스에 도착한 시냅스 소포에는 신경전달물질이 실린다. 이 과정은 신경전달물질 수송체와 전기화학적 기울기를 만드는 양성자 펌프 ATPase가 필요한 능동적인 수송 과정이다. 수송체는 각 신경전달물질에 선택성이 있다. 아세틸콜린 수송체와 소포 GABA 수송체를 부호화하는 unc-17과 unc-47가 현재까지 밝혀져 있다.[10]
- 도킹: 신경전달물질이 들어간 시냅스 소포는 방출 자리 근처에 도킹한다. 도킹에 대해서는 밝혀진 바가 적다. 시냅스 소포 표면과 방출 자리에 있는 단백질은 밝혀졌지만, 그 중에서 도킹 단계를 설명할 수 있는 단백질은 없다. rab-3와 unc-18의 돌연변이는 소포 도킹이나 구성을 변화시킬 수 있지만, 도킹 과정을 완전히 저해하지는 않는다.[11] SNARE 단백질은 이 단계에 관여하지 않는 듯 하다.
- 시동(priming): 시냅스 소포가 도킹한 후 막 융합이 일어나기 전에 시동 과정이 필요하다. 시동 과정은 칼슘 유입에 따라 빠르게 막 융합이 일어날 수 있도록 하는 과정이다. 이 과정에서 SNARE 복합체가 부분적으로 조립되고, Munc13(UNC13B), RIM(RIMS1), 및 RIM-BP 등 단백질이 관여한다.[12] Munc13은 t-SNARE 신택신을 닫힌형에서 열린형으로 전환하고, 이어 v-SNARE/t-SNARE 복합체 조립을 유도한다.[13] RIM은 시동을 조절하지만, 이 단계에서 필수적인 요소는 아니다.
- 막 융합: 세포질에 칼슘 농도가 높아지면 소포는 빠르게 융합한다. 융합 과정은 SNARE 조립으로 얻은 에너지를 이용하며, SNARE가 직접적으로 매개한다. 칼슘을 감지하는 역할은 칼슘 결합 시냅스 소포 단백질인 시냅토타그민(synaptotagmin)이 담당한다. 칼슘 의존적으로 막 융합을 매개하는 SNARE 단백질이 인 비트로에서 구현된 바 있다. 예쁜꼬마선충(C. elegans)에서 v-SNARE와 t-SNARE 돌연변이는 치명적이며, 이것은 융합 과정에서 SNARE가 필수적인 요소라는 사실과 일치한다. 마찬가지로, 초파리속(Drosophila)의 돌연변이와 녹아웃 생쥐 실험에 따르면 SNARE는 시냅스 세포외유출에 중요한 역할을 한다.[7]
- 세포내이입: 이 과정은 완전한 막 융합 모델에서 시냅스 소포가 재흡수되는 과정이다.
소포 재활용
편집시냅스 소포를 재활용하는 기작으로 완전융합 모델(full collapse fusion)과 키스앤런(kiss-and-run) 두 가지가 알려져 있다. 두 기작 모두 세포외공간으로 신경전달물질을 방출하는 시냅스 구멍을 형성하는 것으로 시작한다. 신경전달물질을 방출한 후에 구멍이 완전히 확장되어 최종적으로 시냅스의 세포막으로 완전히 합쳐지거나, 반대로 막을 죄어 구멍이 빠르게 닫힌다(키스앤런 모델).[14]
완전융합 모델
편집시냅스에 강한 자극이 주어지는 동안에는 세포의 전기용량과 표면적이 증가할 뿐만 아니라 소포가 고갈된다.[15] 이는 시냅스 소포가 신경전달물질을 방출한 후에 세포막의 일부가 된다는 것을 의미한다. 호이저(John Heuser)와 리스(Thomas S. Reese)는 시냅스 소포에 HRP(horseradish peroxidase) 꼬리표를 달아 개구리의 신경근육 접합부의 세포막 일부가 세포에 의해 흡수되고 다시 시냅스 소포로 전환된다는 것을 밝혀내었다.[16] 세포외유출의 전 과정, 시냅스 소포를 회수하여 재형성하기까지는 1분이 채 걸리지 않는다.[17]
완전융합 모델에서 시냅스 소포는 세포막에 합쳐서 그 일부가 된다. 새로운 막의 형성은 단백질이 매개하는 과정이고 특정한 조건에서만 일어날 수 있다. 활동전위가 도달하면 시냅스전 막에는 Ca2+가 유입된다. Ca2+은 세포질의 특정한 단백질(그 중 하나가 시냅토타그민이다)에 결합하여 비로소 시냅스 소포가 세포막과 완전히 융합하게 된다. 막에 난 구멍이 완전히 융합되려면 SNARE 단백질의 도움이 필요하다. SNARE 단백질족은 ATP에 의존하여 시냅스 소포의 도킹을 매개한다. 시냅스 소포에 있는 시냅토브레빈과 막에 있는 t-SNARE 복합체(신택신과 SNAP-25로 이루어짐)의 작용으로 시냅스 소포가 세포막에 도킹하고 시동 과정을 거쳐 막에 융합된다.[18]
시냅스 소포가 세포막에 완전히 융합되는 기작은 보툴리눔 및 파상풍 독소의 표적이다. 보툴리눔 독소에는 단백질분해효소 활성이 있어 SNAP-25 단백질을 방해한다. SNAP-25 단백질은 시냅스 소포, 특히 아세틸콜린을 방출하는 소포의 융합에 필수적이다.[19] 보툴리눔 독소는 SNARE 단백질을 절단하고, 따라서 시냅스 소포는 막과 융합하거나 신경전달물질을 방출할 수 없게 된다. 파상풍 독소도 유사한 경로를 통하여 작용하지만, SNARE 단백질 대신 시냅스 소포에 있는 시냅토브레빈 단백질을 공격한다. 이렇듯 보툴리눔과 파상풍 독소는 시냅스 소포가 세포막과 융합되는 것을 막아 근육 연축, 마비, 더 나아가 죽음에 이르게 한다.
키스앤런 모델
편집시냅스 소포가 재활용되는 방법으로 키스앤런 융합(kiss-and-run fusion) 모델도 있다. 시냅스 소포가 세포막 일부와 접촉하면서("kiss") 작은 구멍을 뚫고 소포에 들어 있는 신경전달물질을 방출한 다음, 구멍을 닫고 세포로 돌아간다("run")는 모델이다.[14] 키스앤런 기작과 그 효과를 관찰한 사례는 많지만, 막을 완전히 융합하는 대신 세포가 이 기작을 따르는 이유에 대해서는 연구가 진행 중이다. 다만 자극(입력) 빈도가 높을 때, 그리고 소포가 부족하여 자원을 보존하여야 할 때 키스앤런 기작을 이용할 것으로 예상하고 있다.[20] 버나드 카츠(Bernard Katz)와 델 카스티요(José del Castillo)가 처음 관찰하였으며, 이후에 완전융합 기작과는 달리 키스앤런 기작에서는 세포의 전기용량이 증가하지 않는다는 것이 밝혀졌다.[20] 이로 인하여 키스앤런은 시냅스 소포가 내용물을 방출하고 막에서 분리되는 방식이라는 주장에 힘이 실리게 되었다.
조작
편집세포는 최소한 두 가지 기작, 즉 재활용과 키스앤런을 통하여 막을 재활용하는 것으로 알려져 있다. 특정한 조건에서 세포는 두 기작을 서로 바꿀 수 있다. Ca2+ 농도가 낮을 때에는 시냅스 막에서 느린 전체 막 융합이 우세하게 일어나고, Ca2+ 농도가 높을 때에는 키스앤런 기작이 뒤따른다.
Ales와 동료들은 세포외 칼슘 이온의 농도가 증가하면 농도에 의존하여 시냅스 소포 방출과 재활용 방식은 키스앤런 기작이 우세하게 일어난다고 보고하였다. 시냅스에서 신경전달물질 분비가 일어날 때 최적의 세포외유출-세포내이입 짝반응이 일어나도록 하기 위하여 칼슘이 세포외유출 방식을 조작(modulation)한다.[21]
키스앤런은 또한 자극 연쇄반응이 시작되는 시점에 우세한 기작으로, 이 기작이 신경전달물질 방출 확률이 높다는 것을 나타낸다. 발화 속도와 자극이 빠르면 역시 키스앤런 기작의 빈도가 증가하는데, 전체 막 융합 기작보다 이 방식이 역학적으로 더 빠르다는 것을 의미한다.[22]
각주
편집- ↑ Ikeda K, Bekkers JM (2009). “Counting the number of releasable synaptic vesicles in a presynaptic terminal”. 《Proc Natl Acad Sci U S A.》 106 (8): 2945–50. doi:10.1073/pnas.0811017106. PMC 2650301. PMID 19202060.
- ↑ Qu L, Akbergenova Y, Hu Y, Schikorski T (2009년 3월). “Synapse-to-synapse variation in mean synaptic vesicle size and its relationship with synaptic morphology and function”. 《The Journal of Comparative Neurology》 (Wiley Inter Science) 514 (4): 343–352. doi:10.1002/cne.22007. PMID 19330815. 2013년 1월 5일에 원본 문서에서 보존된 문서. 2015년 1월 15일에 확인함.
- ↑ Tonna N, Bianco F, Matteoli M, Cagnoli C, Antonucci F, Manfredi A, Mauro N, Ranucci E, Ferruti P (2014). “A soluble biocompatible guanidine-containing polyamidoamine as promoter of primary brain cell adhesion andin vitrocell culturing”. 《Science and Technology of Advanced Materials》 15 (4): 045007. doi:10.1088/1468-6996/15/4/045007.
- ↑ 가 나 Benfenati F, Greengard P, Brunner J, Bähler M (1989). “Electrostatic and hydrophobic interactions of synapsin I and synapsin I fragments with phospholipid bilayers”. 《J. Cell Biol.》 108 (5): 1851–62. PMC 2115549. PMID 2497105.
- ↑ Kandel ER, Schwartz JH, Jessell TM, 편집. (2000). 〈14 Transmitter Release〉. 《Principles of Neural Science》 4판. New York: McGraw-Hill. ISBN 0-8385-7701-6.
- ↑ 가 나 Rizzoli SO, Betz WJ (2005년 1월). “Synaptic vesicle pools”. 《Nature Reviews Neuroscience》 6 (1): 57–69. doi:10.1038/nrn1583. PMID 15611727.
- ↑ 가 나 Sudhof TC (2004). “The synaptic vesicle cycle”. 《Annu. Rev. Neurosci.》 27: 509–47. doi:10.1146/annurev.neuro.26.041002.131412. PMID 15217342.
- ↑ Tien NW, Wu GH, Hsu CC, Chang CY, Wagner OI (2011). “Tau/PTL-1 associates with kinesin-3 KIF1A/UNC-104 and affects the motor's motility characteristics in C. elegans neurons”. 《Neurobiol. Dis.》 43 (2): 495–506. doi:10.1016/j.nbd.2011.04.023. PMID 21569846.
- ↑ Arimoto M, Koushika SP, Choudhary BC, Li C, Matsumoto K, Hisamoto N (2011). “The Caenorhabditis elegans JIP3 protein UNC-16 functions as an adaptor to link kinesin-1 with cytoplasmic dynein”. 《J. Neurosci.》 31 (6): 2216–24. doi:10.1523/JNEUROSCI.2653-10.2011. PMID 21307258.
- ↑ Sandoval GM, Duerr JS, Hodgkin J, Rand JB, Ruvkun G (2006). “A genetic interaction between the vesicular acetylcholine transporter VAChT/UNC-17 and synaptobrevin/SNB-1 in C. elegans”. 《Nat. Neurosci.》 9 (5): 599–601. doi:10.1038/nn1685. PMID 16604067.
- ↑ Abraham C, Bai L, Leube RE (2011). “Synaptogyrin-dependent modulation of synaptic neurotransmission in Caenorhabditis elegans”. 《Neuroscience》 190: 75–88. doi:10.1016/j.neuroscience.2011.05.069. PMID 21689733.
- ↑ Kaeser PS, Deng L, Wang Y, Dulubova I, Liu X, Rizo J, Südhof TC (2011). “RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction”. 《Cell》 144 (2): 282–295. doi:10.1016/j.cell.2010.12.029. PMID 21241895.
- ↑ Lin XG, Ming M, Chen MR, Niu WP, Zhang YD, Liu B, Jiu YM, Yu JW, Xu T, Wu ZX (2010). “UNC-31/CAPS docks and primes dense core vesicles in C. elegans neurons”. 《Biochem. Biophys. Res. Commun.》 397 (3): 526–31. doi:10.1016/j.bbrc.2010.05.148. PMID 20515653.
- ↑ 가 나 Breckenridge LJ, Almers W (1987). “Currents through the fusion pore that forms during exocytosis of a secretory vesicle”. 《Nature》 328 (6133): 814–7. doi:10.1038/328814a0. PMID 2442614.
- ↑ Heuser JE, Reese TS (1973). “Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction”. 《J. Cell Biol.》 57 (2): 315–44. PMC 2108984. PMID 4348786.
- ↑ Miller TM, Heuser JE (1984). “Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction”. 《J. Cell Biol.》 98 (2): 685–98. PMC 2113115. PMID 6607255.
- ↑ Ryan TA, Smith SJ, Reuter H (1996). “The timing of synaptic vesicle endocytosis”. 《Proc. Natl. Acad. Sci. U.S.A.》 93 (11): 5567–71. PMC 39287. PMID 8643616.
- ↑ Xu H, Zick M, Wickner WT, Jun Y (2011). “A lipid-anchored SNARE supports membrane fusion”. 《Proc. Natl. Acad. Sci. U.S.A.》 108 (42): 17325–30. doi:10.1073/pnas.1113888108. PMC 3198343. PMID 21987819.
- ↑ Foran PG, Mohammed N, Lisk GO, Nagwaney S, Lawrence GW, Johnson E, Smith L, Aoki KR, Dolly JO (2003). “Evaluation of the therapeutic usefulness of botulinum neurotoxin B, C1, E, and F compared with the long lasting type A. Basis for distinct durations of inhibition of exocytosis in central neurons”. 《J. Biol. Chem.》 278 (2): 1363–71. doi:10.1074/jbc.M209821200. PMID 12381720.
- ↑ 가 나 Harata NC, Aravanis AM, Tsien RW (2006). “Kiss-and-run and full-collapse fusion as modes of exo-endocytosis in neurosecretion”. 《J. Neurochem.》 97 (6): 1546–70. doi:10.1111/j.1471-4159.2006.03987.x. PMID 16805768.
- ↑ Alés E, Tabares L, Poyato JM, Valero V, Lindau M, Alvarez de Toledo G (1999). “High calcium concentrations shift the mode of exocytosis to the kiss-and-run mechanism”. 《Nat. Cell Biol.》 1 (1): 40–4. doi:10.1038/9012. PMID 10559862.
- ↑ Zhang Q, Li Y, Tsien RW (2009). “The dynamic control of kiss-and-run and vesicular reuse probed with single nanoparticles”. 《Science》 323 (5920): 1448–53. doi:10.1126/science.1167373. PMC 2696197. PMID 19213879.
외부 링크
편집- 위키미디어 공용에 시냅스 소포 관련 미디어 분류가 있습니다.