아세트산 칼슘
아세트산의 칼슘염인 화합물
(아세트산칼슘에서 넘어옴)
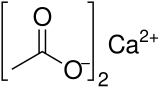
아세트산 칼슘(Calcium acetate)은 아세트산의 칼슘염인 화합물이다. 이 물질의 화학식은 Ca(C2H3O2)2이다. 표준명은 아세트산 칼슘이고, 에타노산 칼슘(calcium ethanoate)은 체계명이다. 이전 이름은 석회 아세테이트(acetate of lime)이다. 무수 형태는 흡습성이 매우 높다. 따라서 일수화물(Ca(CH3COO)2•H2O)이 일반적인 형태이다.
| |
 아세트산 칼슘 결정
| |
| 이름 | |
|---|---|
| 우선명 (PIN)
Calcium diacetate[1] | |
| 별칭
Acetate of lime
Calcium ethanoate | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 약어 | Ca(OAc)2 |
| 3692527 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.492 |
| EC 번호 |
|
| E 번호 | E263 (방부제) |
| 22320 | |
| KEGG | |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C4H6CaO4 | |
| 몰 질량 | 158.166 g/mol (anhydrous) 176.181 g/mol (monohydrate) |
| 겉보기 | White solid hygroscopic |
| 냄새 | slight acetic acid odor |
| 밀도 | 1.509 g/cm3 |
| 녹는점 | 160 °C (320 °F; 433 K)[2] decomposition to CaCO3 + acetone |
| 37.4 g/100 mL (0 °C) 34.7 g/100 mL (20 °C) 29.7 g/100 mL (100 °C) | |
| 용해도 | slightly soluble in methanol, hydrazine insoluble in acetone, ethanol and benzene |
| 산성도 (pKa) | ca. 0.7 |
자화율 (χ)
|
-70.7·10−6 cm3/mol |
굴절률 (nD)
|
1.55 |
| 약리학 | |
| V03AE07 (WHO) | |
| 위험 | |
| NFPA 704 (파이어 다이아몬드) | |
| 680 to 730 °C (1,256 to 1,346 °F; 953 to 1,003 K) | |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
4280 mg/kg (oral, rat) |
| 관련 화합물 | |
다른 양이온
|
마그네슘 아세테이트 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
생산 편집
아세트산 칼슘은 탄산 칼슘(계란 껍질이나 석회석이나 대리석과 같은 일반적인 탄산염 암석에서 발견됨) 또는 수화석회를 식초에 담가서 제조할 수 있다.
- CaCO3(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + H2O(l) + CO2(g)
- Ca(OH)2(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + 2H2O(l)
두 시약 모두 선사 시대부터 이용 가능했기 때문에 그 화학 물질은 그 당시 결정으로 관찰될 수 있었을 것이다.
각주 편집
- ↑ International Union of Pure and Applied Chemistry (2014). 《Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013》. The Royal Society of Chemistry. 801쪽. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ Dale L. Perry (2011년 5월 19일). 《Handbook of Inorganic Compounds》 Seco판. Taylor & Francis. 84쪽. ISBN 978-1-4398-1461-1.
