황화 수소
황화 수소(黃化水素, 영어: hydrogen sulfide)는 황과 수소로 이루어진 화합물이다. 분자식은 H2S이다. 자연에서는 화산 가스나 광천수에도 포함되어 있고, 황을 포함한 단백질의 부패로도 발생한다.[9]

| |||
| |||
| 이름 | |||
|---|---|---|---|
| 체계명
Hydrogen sulfide[1] | |||
별칭
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 3DMet | |||
| 3535004 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.070 | ||
| EC 번호 |
| ||
| 303 | |||
| KEGG | |||
| MeSH | Hydrogen+sulfide | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1053 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| H2S | |||
| 몰 질량 | 34.08 g·mol−1 | ||
| 겉보기 | 무색 기체 | ||
| 냄새 | Pungent, like that of rotten eggs | ||
| 밀도 | 1.363 g dm−3 | ||
| 녹는점 | −82 °C (−116 °F; 191 K) | ||
| 끓는점 | −60 °C (−76 °F; 213 K) | ||
| 4 g dm−3 (at 20 °C) | |||
| 증기 압력 | 1740 kPa (at 21 °C) | ||
| 산성도 (pKa) | 7.0[2][3] | ||
| 짝산 | 설포늄 | ||
| 짝염기 | Bisulfide | ||
자화율 (χ)
|
−25.5·10−6 cm3/mol | ||
굴절률 (nD)
|
1.000644 (0 °C)[4] | ||
| 구조 | |||
| C2v | |||
| Bent | |||
| 0.97 D | |||
| 열화학 | |||
열용량 (C)
|
1.003 J K−1 g−1 | ||
표준 몰 엔트로피 (S
|
206 J mol−1 K−1[5] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−21 kJ mol−1[5] | ||
| 위험 | |||
| 주요 위험 | Flammable and highly toxic | ||
EU classification (DSD) (outdated)
|
|||
| R-phrases (outdated) | R12, R26, R50 | ||
| S-phrases (outdated) | (S1/2), S9, S16, S36, S38, S45, S61 | ||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | −82.4 °C (−116.3 °F; 190.8 K) [8] | ||
| 232 °C (450 °F; 505 K) | |||
| 폭발 한계 | 4.3–46% | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LC50 (median concentration)
|
| ||
LCLo (lowest published)
|
| ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
C 20 ppm; 50 ppm [10-minute maximum peak][6] | ||
REL (권장)
|
C 10 ppm (15 mg/m3) [10-minute][6] | ||
IDLH (직접적 위험)
|
100 ppm[6] | ||
| 관련 화합물 | |||
관련 hydrogen chalcogenides
|
|||
관련 화합물
|
포스핀 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
성질
편집물리적 성질
편집상온에서는 무색 기체로 존재한다. 특유의 달걀 썩는 냄새가 나며, 유독성이다. 녹는점은 -82.9°C, 끓는점은 -59.6°C이다. 임계 온도는 100.5°C, 임계 압력은 89atm이다. 물에 대한 용해도는 0°C에서 437ml/100ml, 40°C에서 186ml/100ml이다. 에탄올, 이황화 탄소 등에 녹는다.[9] 비중은 공기가 1일 때 1.1895로 공기보다 무겁다.[10]
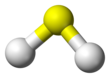
분자는 이등변삼각형 모양을 하고 있으며, 수소 원자와 황 원자 간의 간격은 1.345Å이다. H-S-H 결합각은 92°이다.[9]
화학적 성질
편집공기 중에서는 청색 불꽃을 내며 타서 이산화 황이 된다. 400°C에서 분해되고 1700°C에서는 완전히 성분 원소로 분해된다. 수용액에서는 이양성자산으로 작용하고, 1차 이온화 상수는 0.9X10-7, 2차 이온화 상수는 0.12X10-4이다.[9]
플루오린, 염소, 브로민, 아이오딘과 반응하여 각 원소에 해당하는 할로겐산을 만든다. 은, 납, 구리, 망가니즈와 같은 중금속과 반응하여 금속 황화물을 만든다. 이 성질은 분석 화학에서 이들 금속을 분리하는 목적으로도 사용된다.[10]
제법
편집황화 수소는 황화물을 가수분해 할 경우에 자주 발생한다. 실험적으로는 황화물에 산을 반응시켜 얻거나, 싸이오아세트아마이드(CH3CSNH2)를 가열하여 얻는다.
공업적으로는 주로 다음과 같은 세가지 방법을 사용한다.[10]
용도
편집황화 수소는 주로 다음과 같은 용도로 사용된다.
황화 수소는 많은 화학 공정에서 부산물로 생성되는데, 이 경우 황이나 황산으로 전환시키는 방법으로 처리한다.[10]
안전성
편집황화 수소는 독성을 가지고 있기 때문에 주의해서 다루어야 한다.[11] 게다가 발화점이 260°C로 낮고, 발화 범위가 부피 백분율로 4.3~44%로 넓기 때문에 폭발에 주의해야 한다.[10]
섭취 시 점막을 자극하여 타액분비과다와 함께 타는듯한 느낌을 일으킨다. 위장에 자극을 줄 수 있다.[12]
황화 수소는 흡입 시 혈액의 효소와 반응하여 세포 호흡을 방해하고 그 결과 폐의 마비, 갑작스런 쓰러짐, 사망을 일으킬 수 있다. 저농도(15~50ppm)에서의 지속적인 노출은 점막에 자극을 주고, 두통, 어지러움, 구역질을 유발할 수 있다. 고농도(200~300ppm)에서는 질식을 일으켜 혼수상태를 일으키거나 의식을 잃게 할 수 있다. 700ppm 이상에서 30분 이상 노출되면 치명적일 수 있다.[12]
피부와 접촉하면 피부를 자극할 수 있다.[12]
저농도에서의 안구 노출은 결막에 자극을 준다. 저농도에서의 반복적인 노출은 결막염, 광선 공포증, 각막 수포, 눈물, 통증, 흐린 시야를 일으킬 수 있다.[12]
같이 보기
편집각주
편집- ↑ “Hydrogen Sulfide - PubChem Public Chemical Database”. 《The PubChem Project》. USA: National Center for Biotechnology Information.
- ↑ Perrin, D.D. (1982). 《Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution》 2판. Oxford: Pergamon Press.
- ↑ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432–433.
- ↑ Patnaik, Pradyot (2002). 《Handbook of Inorganic Chemicals》. McGraw-Hill. ISBN 978-0-07-049439-8.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles》 6판. Houghton Mifflin Company. A23쪽. ISBN 978-0-618-94690-7.
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0337”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ 가 나 “Hydrogen sulfide”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ “Hydrogen sulfide”. 《npi.gov.au》. 2013년 5월 30일에 원본 문서에서 보존된 문서. 2020년 11월 20일에 확인함.
- ↑ 가 나 다 라 化學大辭典編集委員會 편, 성용길, 김창홍 역, 〈황화수소〉, 《화학대사전》(Vol. 10), 서울: 世和, 2001, 789~799쪽.
- ↑ 가 나 다 라 마 Considine, G. D. et al., HYDROGEN SULFIDE, Van Nostrand's encyclopedia of chemistry, 5th edition, Hoboken: Wiley-Interscience, 2005, p. 807.
- ↑ 참고로 황화 수소의 독성은 사이안화 수소(HCN)보다 더 강하다. (자유아카데미 제2판 실용무기화학 제495페이지 황화수소편 참조)
- ↑ 가 나 다 라 “황화 수소 MSDS” (PDF). 2006년 10월 20일에 원본 문서 (PDF)에서 보존된 문서. 2008년 5월 31일에 확인함.
참고 문헌
편집- Considine, G. D. et al., Van Nostrand's encyclopedia of chemistry, 5th edition, Hoboken: Wiley-Interscience, 2005.
- Oxtoby, D. W. et al., Principles of Modern Chemisty, 6th edition, Belmont: Thomson Brooks/Cole, 2007.
- 化學大辭典編集委員會 편, 성용길, 김창홍 역, 《화학대사전》, 서울: 世和, 2001.
- 제2판 실용무기화학, 원저 Geoff Rayner-Canham, 역자 김시중 외 6인, 자유아카데미, 2002년 9월 3일 발행.
- https://web.archive.org/web/20061020023052/http://www.vngas.com/pdf/g94.pdf