피루브산 탈수소효소 키네이스 2
피루브산 탈수소효소 키네이스 2(영어: pyruvate dehydrogenase kinase 2, PDK2)는 사람에서 PDK2 유전자에 의해 암호화되는 효소이다.[5][6] 피루브산 탈수소효소 리포아마이드 키네이스 동질효소 2, 미토콘드리아(영어: pyruvate dehydrogenase lipoamide kinase isozyme 2, mitochondrial)라고도 한다. PDK2는 피루브산 탈수소효소 키네이스(PDK)의 동질효소를 암호화한다.
구조
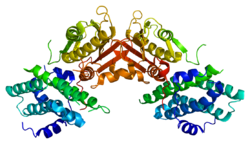
편집PDK2 유전자에 의해 암호화된 단백질은 이 효소의 활성과 조절을 가능하게 하는 활성 부위와 다른 자리 입체성 부위라는 두 개의 부위를 가지고 있다. 이 효소의 조절에 중요한 구조적 모티프가 많이 있다. Nov3r 및 AZ12 저해제는 R 도메인의 한쪽 끝에 위치한 리포아마이드 결합 부위에 결합한다. Pfz3는 R 도메인의 다른 쪽 끝에 있는 확장된 부위에 결합한다. 저해제 중 하나인 다이클로로아세트산(DCA)은 R 도메인의 중앙에 결합한다.[7] 활성 부위 내에는 R250, T302, Y320이라는 3개의 아미노산 잔기가 있는데, 이는 키네이스가 저해제인 다이클로로아세트산에 저항성을 갖도록 만들어 활성 부위를 다른 자리 입체성 부위로부터 짝을 풀리게 한다. 이는 R250, T302, Y320이 뉴클레오타이드 결합 구멍으로의 뉴클레오타이드의 접근을 제어하는 내장된 덮개의 "열린" 및 "닫힌" 입체구조를 안정화한다는 이론을 뒷받침한다. 이는 ATP 덮개의 이동성이 키네이스 분자의 활성 부위와 다른 자리 입체성 부위 사이의 통신에 필요한 입체구조적 스위치 역할을 하는 PDHK2 활성의 다른 자리 입체성 조절의 중심이라는 것을 강력히 시사한다.[8] 다이클로로아세트산, 뉴클레오타이드 및 리포일 도메인 결합 부위 통신을 매가하는 데 중요한 DW 모티프도 있다. 이 네트워크는 닫힌 입체구조 또는 비활성 입체구조로 잠긴 PDK2를 렌더링하는 역할을 담당한다.[9]
기능
편집피루브산 탈수소효소 복합체(PDC)는 일반적인 대사에서 중심적인 역할을 하기 때문에 엄격하게 조절되어야 한다. 피루브산 탈수소효소 복합체 내에는 E1 성분에 인산화 부위인 3개의 세린 잔기가 있다. 이 인산화는 복합체를 비활성화시킨다. 사람에서는 PDK1, PDK2, PDK3, PDK4의 3가지 부위를 인산화하는 것으로 밝혀진 피루브산 탈수소효소 키네이스의 4가지 동질효소가 있다.[10] PDK2는 사람의 조직에서 가장 풍부한 동질형으로 확인되었다. 많은 연구를 통해 이 효소의 활성은 휴식 상태에서도 해당과정/탄수화물 산화를 조절하고 산화적 인산화 및 전자전달계를 위한 대사 산물을 생성하는 데 필수적이라는 것이 분명해졌다. 이들 연구는 PDK 동질형 집단, 특히 PDK2의 반응속도론이 피루브산 탈수소효소 키네이스(PDK)의 활성을 측정하는 것보다 피루브산 탈수소효소(PDH) 활성을 결정하는데 더 중요하다는 것을 보여주었다.[11]
조절
편집중심 대사 경로의 중요한 단계의 주요 조절자로서 피루브산 탈수소효소 패밀리는 수많은 요인에 의해 자체적으로 엄격하게 조절된다. PDK2의 활성은 낮은 수준의 과산화 수소에 의해 조절된다. 이는 화합물이 효소의 Cys45와 Cys392를 일시적으로 산화시켜 PDK2가 비활성화되고 PDH 활성이 더 커지기 때문에 일어난다. 이러한 조건은 산소 호흡의 다음 단계인 시트르산 회로도 비활성화시킨다. 이는 영양 과잉으로 인해 일어날 수 있는 미토콘드리아의 O2 생성 수준이 높을 때 생성물의 증가가 미토콘드리아 대사를 조절하는 음성 피드백 역할을 한다는 사실을 암시한다.[12] PDK2는 PDK3 및 PDK4와 함께 퍼옥시좀 증식인자 활성화 수용체 델타 또는 베타의 주요 표적이며, PDK2는 이러한 수용체에 반응하는 두 가지 요소를 가지고 있다.[13]
임상적 중요성
편집모든 피루브산 탈수소효소 동질효소는 당뇨병을 포함한 다양한 대사 이상과 관련이 있다. 이는 지속적으로 증가된 유리 지방산 수준이 PDK 특히, 간의 PDK2 및 PDK4를 자극하는 메커니즘 때문이다. 이 달성을 자극하면 PDH 활성이 줄어들고 따라서 포도당 흡수도 줄어든다.[14]
암
편집PDK는 중심 대사 및 성장과 연관되어 있기 때문에 보통 암 진행의 다양한 메커니즘과 연관되어 있다. 강화된 PDK2 활성은 바르부르크 효과로 알려진 해당과정과 젖산 생성의 증가로 이어진다. 일부 연구에서는 야생형 종양 단백질 p53이 PDK2 활성을 조절하여 종양형성을 방지한다.[15] 추가적으로 PDK2의 저해는 프롤릴 하이드록실화효소(PHD) 의존적 메커니즘과 PHD 비의존적 메커니즘 모두에 의해 암세포에서 HIF1A를 저해한다. 따라서 미토콘드리아를 표적으로 하는 대사 조절제는 피루브산 탈수소효소 활성을 증가시키고 혈관생성도 억제하여 고형 종양에서 정상 산소 상태의 HIF1A 활성화를 유도하는 가성 저산소 신호를 정상화한다.[16]
같이 보기
편집- 피루브산 탈수소효소 키네이스 (PDK)
- 피루브산 탈수소효소 키네이스 1 (PDK1)
- 피루브산 탈수소효소 키네이스 3 (PDK3)
- 피루브산 탈수소효소 키네이스 4 (PDK4)
각주
편집- ↑ 가 나 다 GRCh38: Ensembl release 89: ENSG00000005882 - 앙상블, May 2017
- ↑ 가 나 다 GRCm38: Ensembl release 89: ENSMUSG00000038967 - 앙상블, May 2017
- ↑ “Human PubMed Reference:”. 《National Center for Biotechnology Information, U.S. National Library of Medicine》.
- ↑ “Mouse PubMed Reference:”. 《National Center for Biotechnology Information, U.S. National Library of Medicine》.
- ↑ Gudi R, Bowker-Kinley MM, Kedishvili NY, Zhao Y, Popov KM (Dec 1995). “Diversity of the pyruvate dehydrogenase kinase gene family in humans”. 《The Journal of Biological Chemistry》 270 (48): 28989–94. doi:10.1074/jbc.270.48.28989. PMID 7499431.
- ↑ “Entrez Gene: PDK2 pyruvate dehydrogenase kinase, isozyme 2”.
- ↑ Knoechel TR, Tucker AD, Robinson CM, Phillips C, Taylor W, Bungay PJ, Kasten SA, Roche TE, Brown DG (Jan 2006). “Regulatory roles of the N-terminal domain based on crystal structures of human pyruvate dehydrogenase kinase 2 containing physiological and synthetic ligands”. 《Biochemistry》 45 (2): 402–15. doi:10.1021/bi051402s. PMID 16401071.
- ↑ Klyuyeva A, Tuganova A, Popov KM (Aug 2008). “Allosteric coupling in pyruvate dehydrogenase kinase 2”. 《Biochemistry》 47 (32): 8358–66. doi:10.1021/bi800631h. PMC 2568900. PMID 18627174.
- ↑ Li J, Kato M, Chuang DT (Dec 2009). “Pivotal role of the C-terminal DW-motif in mediating inhibition of pyruvate dehydrogenase kinase 2 by dichloroacetate”. 《The Journal of Biological Chemistry》 284 (49): 34458–67. doi:10.1074/jbc.M109.065557. PMC 2797213. PMID 19833728.
- ↑ Kolobova E, Tuganova A, Boulatnikov I, Popov KM (Aug 2001). “Regulation of pyruvate dehydrogenase activity through phosphorylation at multiple sites”. 《The Biochemical Journal》 358 (Pt 1): 69–77. doi:10.1042/0264-6021:3580069. PMC 1222033. PMID 11485553.
- ↑ Dunford EC, Herbst EA, Jeoung NH, Gittings W, Inglis JG, Vandenboom R, LeBlanc PJ, Harris RA, Peters SJ (Jun 2011). “PDH activation during in vitro muscle contractions in PDH kinase 2 knockout mice: effect of PDH kinase 1 compensation”. 《American Journal of Physiology. Regulatory, Integrative and Comparative Physiology》 300 (6): R1487–93. doi:10.1152/ajpregu.00498.2010. PMID 21411764.
- ↑ Hurd, TR; Collins, Y; Abakumova, I; Chouchani, ET; Baranowski, B; Fearnley, IM; Prime, TA; Murphy, MP; James, AM (2012년 10월 12일). “Inactivation of pyruvate dehydrogenase kinase 2 by mitochondrial reactive oxygen species.”. 《The Journal of Biological Chemistry》 287 (42): 35153–60. doi:10.1074/jbc.m112.400002. PMC 3471752. PMID 22910903.
- ↑ Degenhardt, T; Saramäki, A; Malinen, M; Rieck, M; Väisänen, S; Huotari, A; Herzig, KH; Müller, R; Carlberg, C (2007년 9월 14일). “Three members of the human pyruvate dehydrogenase kinase gene family are direct targets of the peroxisome proliferator-activated receptor beta/delta.”. 《Journal of Molecular Biology》 372 (2): 341–55. doi:10.1016/j.jmb.2007.06.091. PMID 17669420.
- ↑ Bajotto, G; Murakami, T; Nagasaki, M; Qin, B; Matsuo, Y; Maeda, K; Ohashi, M; Oshida, Y; Sato, Y; Shimomura, Y (March 2006). “Increased expression of hepatic pyruvate dehydrogenase kinases 2 and 4 in young and middle-aged Otsuka Long-Evans Tokushima Fatty rats: induction by elevated levels of free fatty acids.”. 《Metabolism: Clinical and Experimental》 55 (3): 317–23. doi:10.1016/j.metabol.2005.09.014. PMID 16483874.
- ↑ Contractor, T; Harris, CR (2012년 1월 15일). “p53 negatively regulates transcription of the pyruvate dehydrogenase kinase Pdk2.”. 《Cancer Research》 72 (2): 560–7. doi:10.1158/0008-5472.can-11-1215. PMID 22123926.
- ↑ Sutendra, G; Dromparis, P; Kinnaird, A; Stenson, TH; Haromy, A; Parker, JM; McMurtry, MS; Michelakis, ED (2013년 3월 28일). “Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer.”. 《Oncogene》 32 (13): 1638–50. doi:10.1038/onc.2012.198. PMID 22614004.
더 읽을거리
편집- Sugden MC, Holness MJ (May 2003). “Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs”. 《American Journal of Physiology. Endocrinology and Metabolism》 284 (5): E855–62. doi:10.1152/ajpendo.00526.2002. PMID 12676647.
- Kobayashi T, Cohen P (Apr 1999). “Activation of serum- and glucocorticoid-regulated protein kinase by agonists that activate phosphatidylinositide 3-kinase is mediated by 3-phosphoinositide-dependent protein kinase-1 (PDK1) and PDK2”. 《The Biochemical Journal》 339 (2): 319–28. doi:10.1042/0264-6021:3390319. PMC 1220160. PMID 10191262.
- Gold MR, Scheid MP, Santos L, Dang-Lawson M, Roth RA, Matsuuchi L, Duronio V, Krebs DL (Aug 1999). “The B cell antigen receptor activates the Akt (protein kinase B)/glycogen synthase kinase-3 signaling pathway via phosphatidylinositol 3-kinase”. 《Journal of Immunology》 163 (4): 1894–905. doi:10.4049/jimmunol.163.4.1894. PMID 10438924.
- Baker JC, Yan X, Peng T, Kasten S, Roche TE (May 2000). “Marked differences between two isoforms of human pyruvate dehydrogenase kinase”. 《The Journal of Biological Chemistry》 275 (21): 15773–81. doi:10.1074/jbc.M909488199. PMID 10748134.
- Steussy CN, Popov KM, Bowker-Kinley MM, Sloan RB, Harris RA, Hamilton JA (Oct 2001). “Structure of pyruvate dehydrogenase kinase. Novel folding pattern for a serine protein kinase”. 《The Journal of Biological Chemistry》 276 (40): 37443–50. doi:10.1074/jbc.M104285200. PMC 2147663. PMID 11483605.
- Kolobova E, Tuganova A, Boulatnikov I, Popov KM (Aug 2001). “Regulation of pyruvate dehydrogenase activity through phosphorylation at multiple sites”. 《The Biochemical Journal》 358 (Pt 1): 69–77. doi:10.1042/0264-6021:3580069. PMC 1222033. PMID 11485553.
- Korotchkina LG, Patel MS (Oct 2001). “Site specificity of four pyruvate dehydrogenase kinase isoenzymes toward the three phosphorylation sites of human pyruvate dehydrogenase”. 《The Journal of Biological Chemistry》 276 (40): 37223–9. doi:10.1074/jbc.M103069200. PMID 11486000.
- Peters SJ, Harris RA, Wu P, Pehleman TL, Heigenhauser GJ, Spriet LL (Dec 2001). “Human skeletal muscle PDH kinase activity and isoform expression during a 3-day high-fat/low-carbohydrate diet”. 《American Journal of Physiology. Endocrinology and Metabolism》 281 (6): E1151–8. doi:10.1152/ajpendo.2001.281.6.e1151. PMID 11701428. S2CID 22798857.
- Tuganova A, Boulatnikov I, Popov KM (Aug 2002). “Interaction between the individual isoenzymes of pyruvate dehydrogenase kinase and the inner lipoyl-bearing domain of transacetylase component of pyruvate dehydrogenase complex”. 《The Biochemical Journal》 366 (Pt 1): 129–36. doi:10.1042/BJ20020301. PMC 1222743. PMID 11978179.
- Boulatnikov I, Popov KM (Feb 2003). “Formation of functional heterodimers by isozymes 1 and 2 of pyruvate dehydrogenase kinase”. 《Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics》 1645 (2): 183–92. doi:10.1016/S1570-9639(02)00542-3. PMID 12573248.
- Hiromasa Y, Roche TE (Sep 2003). “Facilitated interaction between the pyruvate dehydrogenase kinase isoform 2 and the dihydrolipoyl acetyltransferase”. 《The Journal of Biological Chemistry》 278 (36): 33681–93. doi:10.1074/jbc.M212733200. PMID 12816949.
- Watt MJ, Heigenhauser GJ, LeBlanc PJ, Inglis JG, Spriet LL, Peters SJ (Oct 2004). “Rapid upregulation of pyruvate dehydrogenase kinase activity in human skeletal muscle during prolonged exercise”. 《Journal of Applied Physiology》 97 (4): 1261–7. doi:10.1152/japplphysiol.00132.2004. PMID 15169745.
- Bao H, Kasten SA, Yan X, Roche TE (Oct 2004). “Pyruvate dehydrogenase kinase isoform 2 activity limited and further inhibited by slowing down the rate of dissociation of ADP”. 《Biochemistry》 43 (42): 13432–41. doi:10.1021/bi049488x. PMID 15491150.
- Bao H, Kasten SA, Yan X, Hiromasa Y, Roche TE (Oct 2004). “Pyruvate dehydrogenase kinase isoform 2 activity stimulated by speeding up the rate of dissociation of ADP”. 《Biochemistry》 43 (42): 13442–51. doi:10.1021/bi0494875. PMID 15491151.
- Abbot EL, McCormack JG, Reynet C, Hassall DG, Buchan KW, Yeaman SJ (Jun 2005). “Diverging regulation of pyruvate dehydrogenase kinase isoform gene expression in cultured human muscle cells”. 《The FEBS Journal》 272 (12): 3004–14. doi:10.1111/j.1742-4658.2005.04713.x. PMID 15955060. S2CID 21366281.