세포외 배출
세포외 배출(細胞外排出, 영어: exocytosis)[1][2]은 세포가 세포 밖으로(exo- + cytosis) 분자(예: 신경전달물질, 단백질)를 운반하는 능동 수송 및 대량 수송의 한 형태이다. 능동 수송 메커니즘으로서 세포외 배출은 물질을 수송하기 위해 에너지를 사용해야 한다. 세포외 배출과 이에 대응하는 세포내 섭취는 세포에 중요한 대부분의 화학 물질들이 수동적인 수단으로 세포막의 소수성 부분을 통과할 수 없는 크기가 큰 극성 분자들이기 때문에 모든 세포에서 사용된다. 세포외 배출은 많은 양의 분자들이 방출되는 과정이다. 따라서 대량 수송의 한 형태이다. 세포외 배출은 포로솜(porosome)이라고 불리는 세포막의 분비 포털을 통해 일어난다. 포로솜은 세포막에 있는 영구적인 컵 모양의 지질단백질 구조로 분비 소낭이 일시적으로 도킹 및 융합되어 세포로부터 소낭 내 내용물을 방출한다.
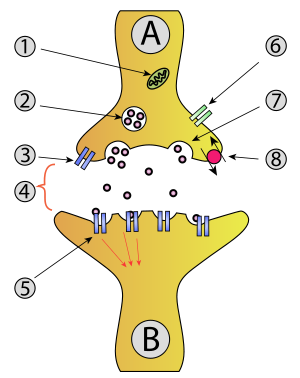
1. 미토콘드리아
2. 신경전달물질이 들어있는 시냅스 소포
3. 자가수용체
4. 신경전달물질이 방출된 시냅스 틈
5. 신경전달물질에 의해 활성화된 시냅스 이후 뉴런의 수용체
6. 칼슘 통로
7. 시냅스 소포의 세포외 배출
8. 회수되는 신경전달물질
세포외 배출에서 분비 소낭은 세포막으로 운반되어 포로솜에 도킹 및 융합되어 그 내용물(즉, 수용성 분자)은 세포외 환경으로 분비된다. 이러한 분비는 소낭이 원형질막과 일시적으로 융합하기 때문에 가능하다. 흥분의 전달의 맥락에서 신경전달물질은 전형적으로 세포외 배출을 통해 시냅스 소포로부터 시냅스 틈으로 방출된다. 그러나 신경전달물질은 막수송단백질을 통한 역수송을 통해 방출될 수도 있다.
세포외 배출은 또한 세포가 막단백질(예: 이온 통로 및 세포 표면 수용체), 지질 및 기타 구성 요소들을 세포막으로 삽입할 수 있는 메커니즘이기도 하다. 이러한 막의 구성 요소들을 포함하고 있는 소포는 완전히 융합되어 외부 세포막의 일부가 된다.
역사
편집유형
편집진핵생물에는 다음과 같은 두 가지 유형의 세포외 배출이 있다. 1) Ca2+ 유발 비구성적 세포외 배출(즉, 조절된 세포외 배출)과 2) 비-Ca2+ 유발 구성적 세포외 배출(즉, 조절되지 않는 세포외 배출)이 그것이다. Ca2+ 유발 비구성적 세포외 배출은 외부 신호, 소포에 대한 특정 분류 신호, 클라트린 코트 및 세포내 Ca2+의 증가를 필요로 한다. 뉴런의 화학 시냅스의 세포외 배출은 Ca2+에 의해 유발되고 뉴런 간에 신호를 전달한다. 비 Ca2+ 유발 구성적 세포외 배출은 모든 세포에서 수행되며 세포외 기질 성분의 방출 또는 운반 소포의 융합 후 원형질막에 통합된 새로 합성된 막단백질의 전달을 매개한다.
원핵생물인 그람음성세균의 소포성 세포외 배출은 세 번째 메커니즘이며 최근에 발견된 세포외 배출 방식이다. 주변세포질은 미생물의 생화학적 신호를 진핵 숙주 세포[4] 또는 근처에 있는 다른 미생물[5]로 전달하기 위한 세균성 외막 소포로 만들어져서 숙주의 침입, 내독소혈증, 영양분을 얻기 위해 다른 미생물들과의 경쟁 등의 환경에서 분비되는 미생물을 제어한다. 숙주-병원체 상호작용에서 일어나는 막 소포 수송의 이러한 발견은 또한 세포외 배출이 순전히 진핵세포에서만 일어나는 현상이 아님을 보여주었다.[6]
단계
편집세포외 배출은 다음과 같이 다섯 단계로 구성되어 있다.
소포 수송
편집특정 소포의 수송 단계는 적당히 짧은 거리에 걸쳐 소포를 운반하는 단계이다. 예를 들어 골지체에서 세포 표면으로 단백질을 운반하는 소포는 운동 단백질과 세포 골격을 사용하여 목표 지점에 보다 가까워지게 된다. 테더링이 적절해지기 전에 골지체는 단백질을 운반하기 위해 ATP를 필요로 하지 않기 때문에 능동 수송에 사용되는 많은 단백질이 수동 수송으로 설정된다. 액틴 및 미세소관은 여러 운동 단백질들과 함께 이러한 과정에 관여한다. 소포가 목표 지점에 도달하면 이를 억제할 수 있는 테더링 인자와 접촉하게 된다.
소포 테더링
편집보다 안정된 패킹 상호작용과 목표에 대한 소포의 초기의 느슨한 테더링을 구별하는 것이 필요하다. 테더링은 주어진 막 표면(>25 nm)에서 소포 직경의 약 절반 이상의 거리에 있는 링크를 포함한다. 테더링 상호작용은 시냅스에서 시냅스 소포를 집중시키는 데 관여할 가능성이 높다.
테더링된 소포는 또한 세포의 전사 과정에도 관여한다.
소포 도킹
편집분비 소낭은 단단한 t-/v-SNARE 고리 복합체를 통해 세포막의 포로솜에 일시적으로 도킹하고 융합한다.
소포 프라이밍
편집뉴런의 세포외 배출에서 프라이밍이라는 용어는 시냅스 소포의 초기 도킹 후 일어나는 모든 분자들의 재배열과 ATP 의존성 단백질 및 지질 변형을 포함하는 뜻으로 사용되었다. 그러나 세포외 배출이 일어나기 전에 칼슘 이온이 유입되어야 즉각적인 신경전달물질의 방출을 유발시킬 수 있다. 다른 세포 유형의 비-Ca2+ 유발 구성적 세포외 배출에서는 프라이밍 단계가 없다.
소포 융합
편집일시적인 소포 융합은 SNARE 단백질에 의해 일어나며, 소포의 내용물이 세포외 공간(또는 시냅스 틈이 있는 뉴런의 경우)으로 방출된다.
공여체와 수용체 막의 융합은 다음과 같은 세 가지 작업으로 수행된다.
소포 회수
편집시냅스 소포의 회수는 세포내 섭취에 의해 일어난다. 대부분의 시냅스 소포는 포로솜을 통해 막으로 완전한 융합없이(키스 앤 런 융합) 재활용된다. 비구성적 세포외 배출 및 이어지는 세포내 섭취는 에너지를 많이 소비하는 과정이기 때문에 미토콘드리아에 의존한다.[8]
전자 현미경을 사용하여 분비 후 세포를 조사하면 분비 후에 부분적으로 비어 있는 소포의 존재가 증가함을 보여준다. 이것은 분비 과정 동안 소포의 내용물의 일부만 세포에서 나갈 수 있음을 시사한다. 이것은 소포가 일시적으로 포로솜에서 세포막과 연속성을 확립하고 그 내용물의 일부를 배출한 다음 분리, 재밀봉 및 세포질로 들어가는 경우에만 가능하다. 이러한 방식으로 분비 소낭은 그 내용물이 완전히 비워질 때까지 후속되는 세포외 배출, 세포내 섭취에 재사용될 수 있다.[9]
같이 보기
편집각주
편집- ↑ “Exocytosis”. 《OxfordDictionaries.com》. 옥스퍼드 대학교 출판부.
- ↑ “Exocytosis”. 《메리엄-웹스터 사전》.
- ↑ Rieger, R.; Michaelis, A.; Green, M.M. 1991. Glossary of Genetics. Classical and Molecular (Fifth edition). Springer-Verlag, Berlin, [1].
- ↑ YashRoy R C (1993) Eelectron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms. Indian Journal of Animal Sciences, vol. 63, pp. 99-102.https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- ↑ Kadurugamuwa, J L; Beveridge, T J (1996). “Bacteriolytic effect of membrane vesicles from Pseudomonas aeruginosa on other bacterial including pathogens: conceptually new antibiotics”. 《Journal of Bacteriology》 178 (10): 2767–2774. doi:10.1128/jb.178.10.2767-2774.1996. PMC 178010. PMID 8631663.
- ↑ YashRoy, R.C. (1998). “Discovery of vesicular exocytosis in procaryotes and its role in Salmonella invasion” (PDF). 《Current Science》 75 (10): 1062–1066.
- ↑ Georgiev, Danko D .; James F . Glazebrook (2007). 〈Subneuronal processing of information by solitary waves and stochastic processes〉. Lyshevski, Sergey Edward. 《Nano and Molecular Electronics Handbook》. Nano and Microengineering Series. CRC Press. 17–1–17–41쪽. doi:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.
- ↑ Ivannikov, M.; 외. (2013). “Synaptic vesicle exocytosis in hippocampal synaptosomes correlates directly with total mitochondrial volume”. 《J. Mol. Neurosci.》 49 (1): 223–230. doi:10.1007/s12031-012-9848-8. PMC 3488359. PMID 22772899.
- ↑ Boron, WF; Boulpaep, EL (2012), 《Medical Physiology. A Cellular and Molecular Approach》 2, Philadelphia: Elsevier [깨진 링크(과거 내용 찾기)]
외부 링크
편집- 의학주제표목 (MeSH)의 Exocytosis