리토나비르
리토나비르(Ritonavir, RTV)는 노르비르(Norvir)라는 이름으로 판매되며, 후천면역결핍증후군을 치료하기 위해 다른 약물과 함께 사용되는 항레트로바이러스제이다. 이런 다양한 약물을 병용하는 결합 치료법은 고활성 항레트로바이러스 요법(HAART)으로도 알려져 있다. 주로 다른 프로테아제 억제제와 함께 낮은 복용량으로 사용되며, 다른 약물들과 함께 C형 간염 치료를 위해 사용될 수 있다. 경구투여하며, 캡슐보다 알약(tablet)형이 더 높은 효율을 보여준다.[1]
| |

| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
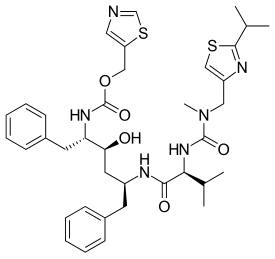
| 1,3-thiazol-5-ylmethyl N-[(2S,3S,5S)-3-hydroxy-5-[(2S)-3-methyl-2-{[methyl({[2-(propan-2-yl)-1,3-thiazol-4-yl]methyl})carbamoyl]amino}butanamido]-1,6-diphenylhexan-2-yl]carbamate | |
| 식별 정보 | |
| CAS 등록번호 | 155213-67-5 |
| ATC 코드 | J05AE03 |
| PubChem | 392622 |
| 드러그뱅크 | DB00503 |
| ChemSpider | 347980 |
| 화학적 성질 | |
| 화학식 | C37H48N6O5S2 |
| 분자량 | 720.946 g/mol |
| SMILES | eMolecules & PubChem |
| 약동학 정보 | |
| 생체적합성 | ? |
| 단백질 결합 | 98-99% |
| 동등생물의약품 | ? |
| 약물 대사 | 간 |
| 생물학적 반감기 | 3-5시간 |
| 배출 | 대부분 대변 |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) B(미국) |
| 법적 상태 | |
| 투여 방법 | 경구 투여 |
일반적인 부작용으로는 메스꺼움, 구토, 식욕부진, 설사, 손발 마비 등이 있다. 심각한 부작용으로는 간 질환, 췌장염, 알레르기 반응, 부정맥 등이 있다. 이러한 심각한 부작용은 아미오다론이나 심바스타틴 등 다른 약물들에서도 나타난다.[1] 적은 복용량에 한정하여 임신 중에도 사용할 수 있는 것으로 보인다.[2] 프로테아제 억제제 등급인데,[1] 일반적으로 다른 프로테아제 억제제 분해효소를 억제하는 용도로 사용된다. 따라서 다른 다른 프로테아제 억제제를 리토나비르와 함께 투여할 경우 적은 양만 투여해도 높은 효과를 볼 수 있다.[3]
리토나비르는 1989년에 특허를 받았고 1996년에 의학적으로 사용되기 시작했다.[4][5] 현재 가장 안전하고 효과적인 의약품으로 의료제도에서 필수적인 의약품 목록인 WHO 필수 의약품 목록에 등재되어 있다.[6] 개발도상국에서의 도매가는 보통 하루에 0.07달러에서 2.20달러 사이로 책정된다.[7] 미국에서는 복용량에 따라 하루에 약 9.20–55달러가 든다.[1]
의학적 사용 편집
리토나비르는 HIV-1 감염 환자(성인 및 2세 이상 어린이)의 치료를 위해 다른 항레트로바이러스 약물과 함께 사용된다.[8][1]
부작용 편집
HIV 치료에 효과적인 초기 테스트 고용량 투여 시 리토나비르의 부작용은 아래와 같다.[9]
- 무력증, 권태감
- 설사
- 메스꺼움과 구토
- 복통
- 현기증
- 불면증
- 발한
- 미각 장애
- 다음을 포함한 대사 효과
- 고콜레스테롤혈증
- 고중성지방혈증
- 아미노전이효소 증가
- 크레아틴 카이네이즈 증가
리토나비르의 부작용 중 하나는 고혈당인데, 이는 리토나비르가 인슐린 조절 수송체 GLUT4를 억제하기 해서, 혈중 포도당이 지방과 근육 세포에 들어가는 것이 억제되기 때문이다. 이것은 인슐린 저항성을 유발하고 타입2 당뇨병환자에게서 문제가 된다.
약물 상호작용 편집
리토나비르는 CYP 1A2를 유도하고 주요 P450 동형 3A4 및 2D6을 억제한다. 다양한 약물과 리토나비르의 병용 요법은 심각한(때로는 치명적인) 약물 상호작용을 유발할 수 있다.[10] 리토나비르의 임상적으로 중요한 상호작용 목록에는 다음과 같은 약물이 포함된다.:
- 아미오다론(amiodarone)—대사감소, 독성 가능;
- 보센탄(bosentan)—CYP3A4를 통한 대사의 감소;
- 미다졸람(midazolam)과 트리아졸람(triazolam)—금기;
- 카르바마제핀(carbamazepine)—대사 감소, 독성 가능성;
- 시사프라이드(Cisapride)—대사 감소, Q-T 간격 연장 및 생명을 위협하는 부정맥;
- 디설피람(disulfiram) (경구 리토나비르(ritonavir)사용시)—리토나비르(ritonavir)대사 감소;
- 에플레레논(eplerenone);
- 에트라비린(etravirine);
- 플레카이니드(flecainide)—대사 감소, 독성 가능성;
- MDMA—대사 감소, 때때로 세로토닌 증후군(치명적임) 같은 독성을 나타냄[11][12]
- 메스칼린(mescaline);
- 메페리딘(meperidine)]] (pethidine)—노르페티딘의 독성 농도 축적
- 닐로티닙(nilotinib);
- 니솔디핀(nisoldipine);
- 옥시코돈(oxycodone)—옥시코돈(oxycodone)의 농도가 크게 증가함;[13]
- 페니토인(phenytoin)—CYP2C9에 의한 페니토인 대사 유도;
- 피모자이드(pimozide);
- 퀴니딘(quinidine);
- 라놀라진(ranolazine);
- 살메테롤(salmeterol);
- 사퀴나비르(saquinavir)—대사억제, 그러나 생체 내 과포화로 인해 생체 이용률 감소;[14]
- St John's wort;
- 스타틴계(statin)—대사감소, 용량을 변경하지 않고 대사를 감소시키면횡문근융해증의 위험이 증가함;
- thioridazine;
- topotecan;
- voriconazole—대사 증가
작용 기작 편집
리토나비르는 원래 유사-C2-대칭 소형분자 억제자 계열 중 하나로, HIV 프로테아제 억제제로 개발되었다. 현재는 본연의 항바이러스적 목적으로 사용되는 경우는 드물고, 보통 다른 프로테아제 억제제의 보조제로 사용한다. 좀더 구체적으로 말하자면, 리토나비르는 간이나 췌장 등에서 발견되는 프로테아제 억제제를 대사하는 효소인 CYP3A4를 억제하기 위해 사용된다.[15] 따라서 낮은 복용량을 다른 단백질 분해효소 억제제와 함께 투여하여 다른 약물을 강화할 수 있다. 이 발견을 통해 부작용이 획기적으로 감소하였으며, 프로테아제 억제제 및 HAART의 효능이 향상되었다. 그러나 CYP3A4의 정상적인 기능 때문에 리토나비르는 다른 정상적인 약물의 효능에도 영향을 끼친다. 따라서 여러 약을 동시에 약을 처방하는 경우 어려움을 가중시킨다.[16]
약물동력학 및 약력학 편집
캡슐은 일반 알약 형태와 비교했을 때 효과가 떨어진다.[1]
역사 편집
리토나비르는 애브비(AbbVie) 주식회사에서 노르비르라는 제품명으로 제조된다. 미국 식품의약국(FDA)에서 1996년 3월 1일 리토나비르를 승인함에 따라 미국에서 승인된 7번째 항레트로바이러스제이자, 4번째 프로테아제 억제제가 되었다. 프로테아제 억제제인 리토나비르와 사퀴나비르를 승인함으로써 강력 항레트로바이러스요법(HAART)을 도입한 결과, 미국의 HIV 연관 사망률은 2년간 5만 명 이상에서 약 1만 8천 명으로 떨어졌다.[18][19]
2003년에는 애봇사(현재의 애브비사)가 노르비르의 가격을 1.71달러에서 8.57달러로 인상함에 따라, 환자 및 의회로부터 비난을 받는다. 이에 따라 소비자그룹은 국립보건원(NIH)에게 노르비르 특허 승인을 번복할 것을 청원하였으나, 2004년 8월 4일 NIH는 그럴 권리가 없다며 이를 거부한다.[20] 2014년 FDA는 옴비스타비르, 파리타프레비르와 함께 묶어서 C형 간염 바이러스 유전자형 4의 치료제로 옴비스타비르/파리타프레비르/리토나비르를 허용한다.[21]
다형성 및 일시적 시장 퇴출 편집
리토나비르는 원래 냉장이 필요하지 않은 기존 캡슐로 판매되었다. 그것은 현재 I형이라고 불리는 리토나비르의 결정형을 포함하고 있다.[22] 그러나 다른 많은 약물과 마찬가지로 결정질 리토나비르는 다형성을 나타낼 수 있다. 즉, 동일한 분자가 둘 이상의 결정 유형 또는 다형성(polymorph)으로 결정화될 수 있다. 각 분자는 동일한 반복 분자를 포함하지만 서로 다른 결정 쌓임 /배열로 되어 있다. 용해성과 그에 따른 생물학적 가용성은 서로 다른 배열에 따라 달라질 수 있으며, 리토나비르의 경우 리토나비르I과 II 형태에서 관찰되었다.[23]
개발 과정에서 리토나비르는 1996년에 처음 도입되었다. 이때는 결정질 형태만 발견되었으며 현재는 I형이라고 불린다. 그러나 1998년[24]에 자유 에너지가 더 낮고 더 안정적인 다형체인 II형이 발견되었다. 안정적인 결정질 형태는 덜 용해되어 생체이용률이 현저히 낮아지게 된다. 약물의 경구 생체 이용률 손상으로 인해 시장에서 경구 캡슐 형태의 약물이 일시적으로 철회되었다.[23]
미량의 II형이 존재하더라도 생체이용률이 더 높은 I형을 II형으로 전환시킬 수 있다는 사실 때문에, II형의 존재는 리토나비르의 경구 캡슐 조성물의 기존 공급 용량을 파괴할 위험이 있다. 실제로, II형은 생산 라인에서 발견되어 리토나비르의 생산을 사실상 중단했다.[22] Abbott(현재 AbbVie)는 시장에서 캡슐을 철회했고 처방자들은 Norvir 현탁액으로 전환하라는 조언을 받게되었다.[출처 필요]
회사의 연구 개발 팀은 궁극적으로 캡슐 모양을 냉각 젤 캡으로 교체하여 문제를 해결했다. 2000년에 Abbott(현 AbbVie)는 냉장이 필요하지 않은 리토나비르를 포함하는 로피나비르/리토나비르 정제(칼레트라) 제형에 대해 FDA 승인을 받았다.[25]
연구 편집
2020년에 로피나비르/리토나비르 고정 용량 복합제는 심각한 COVID-19에서 효과가 없는 것으로 밝혀졌다.[26] 임상시험에서 증상이 시작된 후 약 13일 후에 약물이 시작되었다.[26] 1930년 FDA 승인 약물에 대한 가상 선별 후 분자역학 분석에 따르면 리토나비르는 사스-CoV-2 스파이크(S) 단백질과 인간 세포로의 바이러스 유입에 중요한 인간 안지오텐신 변환효소-2(hACE2) 수용체의 결합을 차단한다고 예측했다.[27]
각주 편집
- ↑ 가 나 다 라 마 바 “Ritonavir”. The American Society of Health-System Pharmacists. 2015년 10월 17일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ “Ritonavir Pregnancy and Breastfeeding Warnings”. 《drugs.com》. 2015년 9월 7일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ 《British National Formulary 69》 69판. Pharmaceutical Pr. 2015년 3월 31일. 426쪽. ISBN 9780857111562.
- ↑ Hacker, Miles (2009). 《Pharmacology principles and practice》. Amsterdam: Academic Press/Elsevier. 550쪽. ISBN 9780080919225.
- ↑ Fischer, Jnos; Ganellin, C. Robin (2006). 《Analogue-based Drug Discovery》 (영어). John Wiley & Sons. 509쪽. ISBN 9783527607495.
- ↑ World Health Organization (2019). 《World Health Organization model list of essential medicines: 21st list 2019》. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ “Ritonavir”. 《International Drug Price Indicator Guide》. 2017년 5월 10일에 원본 문서에서 보존된 문서. 2015년 10월 23일에 확인함.
- ↑ “Norvir EPAR”. 《European Medicines Agency (EMA)》. 2020년 8월 20일에 확인함. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ “Norvir side effects (Ritonavir) and drug interactions - prescription drugs and medications at RxList”. 2007년 6월 27일. 2007년 6월 27일에 원본 문서에서 보존된 문서.
- ↑ “Ritonavir: Drug Information Provided by Lexi-Comp: Merck Manual Professional”. 2008년 4월 30일. 2008년 4월 30일에 원본 문서에서 보존된 문서.
- ↑ Henry, J. A.; Hill, I. R. (1998). “Fatal interaction between ritonavir and MDMA”. 《Lancet》 352 (9142): 1751–1752. doi:10.1016/s0140-6736(05)79824-x. PMID 9848354. S2CID 45334940.
- ↑ Papaseit, E.; Vázquez, A.; Pérez-Mañá, C.; Pujadas, M.; De La Torre, R.; Farré, M.; Nolla, J. (2012). “Surviving life-threatening MDMA (3,4-methylenedioxymethamphetamine, ecstasy) toxicity caused by ritonavir (RTV)”. 《Intensive Care Medicine》 38 (7): 1239–1240. doi:10.1007/s00134-012-2537-9. PMID 22460853. S2CID 19375709.
- ↑ Nieminen, Tuija H.; Hagelberg, Nora M.; Saari, Teijo I.; Neuvonen, Mikko; Neuvonen, Pertti J.; Laine, Kari; Olkkola, Klaus T. (2010). “Oxycodone concentrations are greatly increased by the concomitant use of ritonavir or lopinavir/ritonavir”. 《European Journal of Clinical Pharmacology》 66 (10): 977–985. doi:10.1007/s00228-010-0879-1. ISSN 0031-6970. PMID 20697700. S2CID 25770818.
- ↑ Hsieh, Yi-Ling; Ilevbare, Grace A.; Van Eerdenbrugh, Bernard; Box, Karl J.; Sanchez-Felix, Manuel Vincente; Taylor, Lynne S. (2012년 5월 12일). “pH-Induced Precipitation Behavior of Weakly Basic Compounds: Determination of Extent and Duration of Supersaturation Using Potentiometric Titration and Correlation to Solid State Properties”. 《Pharmaceutical Research》 (영어) 29 (10): 2738–2753. doi:10.1007/s11095-012-0759-8. ISSN 0724-8741. PMID 22580905. S2CID 15502736.
- ↑ Zeldin RK, Petruschke RA (2004). “Pharmacological and therapeutic properties of ritonavir-boosted protease inhibitor therapy in HIV-infected patients”. 《Journal of Antimicrobial Chemotherapy》 53 (1): 4–9. doi:10.1093/jac/dkh029. PMID 14657084. 2007년 8월 21일에 원본 문서에서 보존된 문서.
- ↑ Research, Center for Drug Evaluation and (2019년 12월 3일). “Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers”. 《FDA》 – www.fda.gov 경유.
- ↑ “Wayback Machine” (PDF). 2015년 9월 24일에 원본 문서 (PDF)에서 보존된 문서. 2020년 2월 17일에 확인함.
- ↑ “HIV Surveillance—United States, 1981-2008”. 2013년 11월 9일에 원본 문서에서 보존된 문서. 2013년 11월 8일에 확인함.
- ↑ The CDC, in its Morbidity and Mortality Weekly Report, ascribes this to "highly active antiretroviral therapy", without mention of either of these drugs, see the preceding citation. A further citation is needed to make this accurate connection between this drop and the introduction of the protease inhibitors.
- ↑ Ceci Connolly (2004년 8월 5일). “NIH Declines to Enter AIDS Drug Price Battle”. 《Washington Post》. 2008년 8월 20일에 원본 문서에서 보존된 문서. 2006년 1월 16일에 확인함.
- ↑ “FDA approves Viekira Pak to treat hepatitis C”. Food and Drug Administration. 2014년 12월 19일. 2015년 10월 31일에 원본 문서에서 보존된 문서.
- ↑ 가 나 Bauer J; 외. (2001). “Ritonavir: An Extraordinary Example of Conformational Polymorphism”. 《Pharmaceutical Research》 18 (6): 859–866. doi:10.1023/A:1011052932607. PMID 11474792. S2CID 20923508.
- ↑ 가 나 S. L. Morissette; S. Soukasene; D. Levinson; M. J. Cima; O. Almarsson (2003). “Elucidation of crystal form diversity of the HIV protease inhibitor ritonavir by high-throughput crystallization”. 《Proc. Natl. Acad. Sci. USA》 100 (5): 2180–84. doi:10.1073/pnas.0437744100. PMC 151315. PMID 12604798.
- ↑ Lüttge, Andreas (2006년 2월 1일). “Crystal dissolution kinetics and Gibbs free energy”. 《Journal of Electron Spectroscopy and Related Phenomena》 150 (2): 248–259. doi:10.1016/j.elspec.2005.06.007.
- ↑ “Kaletra FAQ”. 《AbbVie's Kaletra product information》. AbbVie. 2011. 2014년 7월 7일에 원본 문서에서 보존된 문서. 2014년 7월 5일에 확인함.
- ↑ 가 나 Cao, Bin; Wang, Yeming; Wen, Danning; Liu, Wen; Wang, Jingli; Fan, Guohui; 외. (2020년 3월 18일). “A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19”. 《New England Journal of Medicine》 382 (19): 1787–1799. doi:10.1056/NEJMoa2001282. PMC 7121492. PMID 32187464.
- ↑ Bagheri, Milad; Niavarani, Ahmadreza (2020년 10월 8일). “Molecular dynamics analysis predicts ritonavir and naloxegol strongly block the SARS-CoV-2 spike protein-hACE2 binding”. 《Journal of Biomolecular Structure and Dynamics》 0: 1–10. doi:10.1080/07391102.2020.1830854. ISSN 0739-1102. PMID 33030105. S2CID 222217607.
참고 문헌 편집
- Chemburkar, Sanjay R.; Bauer, John; Deming, Kris; Spiwek, Harry; Patel, Ketan; Morris, John; Henry, Rodger; Spanton, Stephen; 외. (2000). “Dealing with the Impact of Ritonavir Polymorphs on the Late Stages of Bulk Drug Process Development”. 《Organic Process Research & Development》 4 (5): 413–417. doi:10.1021/op000023y.
외부 링크 편집
- PubPK - Ritonavir pharmacokinetics Archived 2009년 11월 9일 - 웨이백 머신
- [1] (manufacturer's website)
- Ritonavir bound to proteins in the PDB
- Norvir Prescribing Information