탄산 나트륨
화합물
(소다회에서 넘어옴)
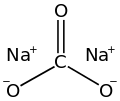
탄산 나트륨(Na2CO3)은 화합물의 한 종류로, 탄산과 수산화나트륨의 염이다. 유리에 주로 포함되어 있어 빛이 통과할 때 자외선을 차단해 주는 역할을 하기도 한다. 상수도에서 정수 과정 중 pH를 조절하기 위해 사용되기도 한다.[12] 탄산 나트륨은 나트륨 이온(Na+)이 포함되어 있어 물에 잘 녹는다.[13]
| |

| |
| 이름 | |
|---|---|
| IUPAC 이름
Sodium carbonate
| |
| 별칭
Soda ash, washing soda, soda crystals, sodium trioxocarbonate
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.007.127 |
| EC 번호 |
|
| E 번호 | E500(i) (산도 조절제, ...) |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| Na2CO3 | |
| 몰 질량 | 105.9888 g/mol (anhydrous) 286.1416 g/mol (decahydrate) |
| 겉보기 | White solid, hygroscopic |
| 냄새 | Odorless |
| 밀도 | |
| 녹는점 | 851 °C (1,564 °F; 1,124 K) (Anhydrous) 100 °C (212 °F; 373 K) decomposes (monohydrate) 33.5 °C (92.3 °F; 306.6 K) decomposes (heptahydrate) 34 °C (93 °F; 307 K) (decahydrate)[2][6] |
Anhydrous, g/100 mL:
| |
| 용해도 | Soluble in aq. alkalis,[3] glycerol Slightly soluble in aq. alcohol Insoluble in CS2, 아세톤, alkyl acetates, alcohol, benzonitrile, liquid ammonia[4] |
| glycerine에서의 용해도 | 98.3 g/100 g (155 °C)[4] |
| ethanediol에서의 용해도 | 3.46 g/100 g (20 °C)[5] |
| dimethylformamide에서의 용해도 | 0.5 g/kg[5] |
| 염기도 (pKb) | 3.67 |
자화율 (χ)
|
−4.1·10−5 cm3/mol[2] |
굴절률 (nD)
|
1.485 (anhydrous) 1.420 (monohydrate)[6] 1.405 (decahydrate) |
| 점도 | 3.4 cP (887 °C)[5] |
| 구조 | |
| Monoclinic (γ-form, β-form, δ-form, anhydrous)[7] Orthorhombic (monohydrate, heptahydrate)[1][8] | |
| C2/m, No. 12 (γ-form, anhydrous, 170 K) C2/m, No. 12 (β-form, anhydrous, 628 K) P21/n, No. 14 (δ-form, anhydrous, 110 K)[7] Pca21, No. 29 (monohydrate)[1] Pbca, No. 61 (heptahydrate)[8] | |
| 2/m (γ-form, β-form, δ-form, anhydrous)[7] mm2 (monohydrate)[1] 2/m 2/m 2/m (heptahydrate)[8] | |
a = 8.920(7) Å, b = 5.245(5) Å, c = 6.050(5) Å (γ-form, anhydrous, 295 K)[7] α = 90°, β = 101.35(8)°, γ = 90°
| |
| Octahedral (Na+, anhydrous) | |
| 열화학 | |
열용량 (C)
|
112.3 J/mol·K[2] |
표준 몰 엔트로피 (S
|
135 J/mol·K[2] |
표준 생성 엔탈피 (ΔfH⦵298)
|
−1130.7 kJ/mol[2][5] |
기브스 자유 에너지 (ΔfG˚)
|
−1044.4 kJ/mol[2] |
| 위험 | |
| 주요 위험 | Irritant |
| 물질 안전 보건 자료 | MSDS |
| GHS 그림문자 |  [9] [9]
|
| 신호어 | 경고 |
| H319[9] | |
| P305+351+338[9] | |
| NFPA 704 (파이어 다이아몬드) | |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
4090 mg/kg (rat, oral)[10] |
| 관련 화합물 | |
다른 음이온
|
Sodium bicarbonate |
다른 양이온
|
Lithium carbonate Potassium carbonate Rubidium carbonate Caesium carbonate |
관련 화합물
|
Sodium sesquicarbonate Sodium percarbonate |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
같이 보기
편집각주
편집- ↑ 가 나 다 라 Harper, J.P (1936). Antipov, Evgeny; Bismayer, Ulrich; Huppertz, Hubert; Petrícek, Václav; Pöttgen, Rainer; Schmahl, Wolfgang; Tiekink, E.R.T.; Zou, Xiaodong, 편집. “Crystal Structure of Sodium Carbonate Monohydrate, Na2CO3. H2O”. 《Zeitschrift für Kristallographie - Crystalline Materials》 95 (1): 266–273. doi:10.1524/zkri.1936.95.1.266. ISSN 2196-7105. 2014년 7월 25일에 확인함.
- ↑ 가 나 다 라 마 바 사 Lide, David R., 편집. (2009). 《CRC Handbook of Chemistry and Physics》 90판. Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ↑ 가 나 Seidell, Atherton; Linke, William F. (1919). 《Solubilities of Inorganic and Organic Compounds》 2판. New York: D. Van Nostrand Company. 633쪽.
- ↑ 가 나 Comey, Arthur Messinger; Hahn, Dorothy A. (February 1921). 《A Dictionary of Chemical Solubilities: Inorganic》 2판. New York: The MacMillan Company. 208–209쪽.
- ↑ 가 나 다 라 Anatolievich, Kiper Ruslan. “sodium carbonate”. 《chemister.ru》. 2014년 7월 25일에 확인함.
- ↑ 가 나 Pradyot, Patnaik (2003). 《Handbook of Inorganic Chemicals》. The McGraw-Hill Companies, Inc. 861쪽. ISBN 978-0-07-049439-8.
- ↑ 가 나 다 라 Dusek, Michal; Chapuis, Gervais; Meyer, Mathias; Petricek, Vaclav (2003). “Sodium carbonate revisited” (PDF). 《Acta Crystallographica Section B》 59 (3): 337–352. doi:10.1107/S0108768103009017. ISSN 0108-7681. PMID 12761404. 2014년 7월 25일에 확인함.
- ↑ 가 나 다 Betzel, C.; Saenger, W.; Loewus, D. (1982). “Sodium Carbonate Heptahydrate”. 《Acta Crystallographica Section B》 38 (11): 2802–2804. doi:10.1107/S0567740882009996.
- ↑ 가 나 다 Sigma-Aldrich Co. Retrieved on 2014-05-06.
- ↑ Chambers, Michael. “ChemIDplus - 497-19-8 - CDBYLPFSWZWCQE-UHFFFAOYSA-L - Sodium carbonate [NF] - Similar structures search, synonyms, formulas, resource links, and other chemical information”.
- ↑ “Material Safety Data Sheet – Sodium Carbonate, Anhydrous” (PDF). 《conservationsupportsystems.com》. ConservationSupportSystems. 2014년 7월 25일에 확인함.
- ↑ 노재식 외 (2016). 《토목기사 대비 상하수도 공학》. 한솔아카데미. 158-159쪽. ISBN 979-11-5656-234-4.
- ↑ 김봉래 외 2 (2006년 7월 1일). 《완자 화학 Ⅰ(1권)》 초판. 비유와상징. 29쪽.
외부 링크
편집- 위키미디어 공용에 탄산 나트륨 관련 미디어 분류가 있습니다.
