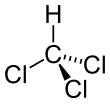
클로로포름
화합물
클로로포름(Chloroform)은 탄소와 염소로 이루어진 화합물로, 화학식은 CHCl3이다. 테프론이나 냉매를 만드는 데 사용되기도 한다.[8]
| |||

| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Trichloromethane | |||
| 별칭
Chloroform[1]
Methane trichloride Methyl trichloride Methenyl trichloride Methenyl chloride TCM Freon 20 Refrigerant-20 R-20 UN 1888 | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.603 | ||
| EC 번호 |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| CHCl3 | |||
| 몰 질량 | 119.37 g·mol−1 | ||
| 겉보기 | Colorless liquid | ||
| 냄새 | Misleadingly-pleasant ethereal odor, leading to olfactory fatigue | ||
| 밀도 | 1.564 g/cm3 (−20 °C) 1.489 g/cm3 (25 °C) 1.394 g/cm3 (60 °C) | ||
| 녹는점 | −63.5 °C (−82.3 °F; 209.7 K) | ||
| 끓는점 | 61.15 °C (142.07 °F; 334.30 K) decomposes at 450 °C | ||
| 10.62 g/L (0 °C) 8.09 g/L (20 °C) 7.32 g/L (60 °C) | |||
| 용해도 | Soluble in 벤젠 Miscible in 다이에틸 에터, oils, ligroin, alcohol, CCl4, CS2 | ||
| acetone에서의 용해도 | ≥ 100 g/L (19 °C) | ||
| dimethyl sulfoxide에서의 용해도 | ≥ 100 g/L (19 °C) | ||
| 증기 압력 | 0.62 kPa (−40 °C) 7.89 kPa (0 °C) 25.9 kPa (25 °C) 313 kPa (100 °C) 2.26 MPa (200 °C) | ||
헨리 상수 (kH)
|
3.67 L·atm/mol (24 °C) | ||
| 산성도 (pKa) | 15.7 (20 °C) | ||
| UV-vis (λmax) | 250 nm, 260 nm, 280 nm | ||
자화율 (χ)
|
−59.30·10−6 cm3/mol | ||
| 열전도율 | 0.13 W/m·K (20 °C) | ||
굴절률 (nD)
|
1.4459 (20 °C) | ||
| 점도 | 0.563 cP (20 °C) | ||
| 구조 | |||
| Tetrahedral | |||
| 1.15 D | |||
| 열화학 | |||
열용량 (C)
|
114.25 J/mol·K | ||
표준 몰 엔트로피 (S
|
202.9 J/mol·K | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−134.3 kJ/mol | ||
기브스 자유 에너지 (ΔfG˚)
|
−71.1 kJ/mol | ||
표준 연소 엔탈피 (ΔcH⦵298)
|
473.21 kJ/mol | ||
| 약리학 | |||
| N01AB02 (WHO) | |||
| 위험[7] | |||
| 주요 위험 | Carcinogen – Reproductive toxicity – Specific target organ toxicity (STOT)[2][3][4] | ||
| 물질 안전 보건 자료 | [1] | ||
| GHS 그림문자 |  
| ||
| 신호어 | 위험 | ||
| H302, H315, H319, H331, H336, H351, H361d, H372 | |||
| P201, P202, P260, P264, P270, P271, P280, P281, P301+330+331, P310, P302+352, P304+340, P311, P305+351+338, P308+313, P314, P332+313, P337+313, P362, P403+233, P235, P405, P501 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | Non-flammable | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
704 mg/kg (mouse, dermal)[5] | ||
LC50 (median concentration)
|
9,617 ppm (rat, 4 hr)[6] | ||
LCLo (lowest published)
|
20,000 ppm (guinea pig, 2 hr) 7,056 ppm (cat, 4 hr) 25,000 ppm (human, 5 min)[6] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
50 ppm (240 mg/m3)[3] | ||
REL (권장)
|
Ca ST 2 ppm (9.78 mg/m3) [60-minute][3] | ||
IDLH (직접적 위험)
|
500 ppm[3] | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
성질
편집상온에서 액체 상태로 존재하는 비교적 무거운 무색의 화합물이다. 녹는점은 -63.5 °C, 끓는점은 61.2 °C이고 밀도는 1.483 g/cm3이다. 기화성이 높으며, 기체 클로로포름은 본드 냄새가 난다. 흡입 시 마취효과가 있다.
생산 방법
편집클로로포름은 염소 기체와 메탄이나 염화메틸의 혼합물에 열을 가해 만들어진다. 400–500 °C에서 다음과 같은 반응이 일어난다.
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
클로로포름이 다음 과정을 거치면 CCl4가 된다.:
- CHCl3 + Cl2 → CCl4 + HCl
이 과정에서는 모두 클로로 메탄(염화메틸), 염화에틸렌, 클로로포름, 사염화탄소가 만들어지고 이 화합물들은 증류로 분리된다.[8]
각주
편집- ↑ 〈Front Matter〉. 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 661쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The retained names 'bromoform' for HCBr3, 'chloroform' for HCCl3, and 'iodoform' for HCI3 are acceptable in general nomenclature. Preferred IUPAC names are substitutive names.
- ↑ “Part 3 Health Hazards” (PDF). 《Globally Harmonized System of Classification and Labelling of Chemicals (GHS)》. Second revised edition. United Nations. 2017년 9월 30일에 확인함.
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0127”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ Toxicity on PubChem
- ↑ Lewis, Richard J. (2012). 《Sax's Dangerous Properties of Industrial Materials》 12판. ISBN 978-0-470-62325-1.
- ↑ 가 나 “Chloroform”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ “PubChem: Safety and Hazards - GHS Classification”. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ 가 나 M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim.
외부 링크
편집- 위키미디어 공용에 클로로포름 관련 미디어 분류가 있습니다.