벤젠
벤젠(영어: benzene) 또는 벤졸(benzol)은 휘발성 액체 탄화수소로 콜타르를 증류, 정제하여 만든다. 6개의 탄소 원자가 동일 평면에 있는 평면 정육각형의 고리구조를 가졌으며 가장 기본적인 방향족 탄화수소 물질이고 대표적인 아눌렌(6-아눌렌)이다. 무색이고 가연성이 있으며, 발암 물질로도 알려져 있다. 비등점은 섭씨 80.1도이고 화학식은 C6H6이다. 가끔 페닐기에 수소가 붙어 있다는 의미로 Ph-H로 표기되기도 한다. 상대적으로 높은 끓는점을 가진 것으로 알려져 있으며 달콤한 냄새를 가진 것이 특징이다. 발암성 때문에 가솔린에의 첨가는 제한되었지만 화학 공정에서 중요한 용매로 사용되며, 약품, 플라스틱, 인조 고무, 염료, 향료, 폭약 등의 원료로 쓰인다. 벤젠은 원유의 성분이며, 석유에 존재하는 다른 물질들을 통해서 합성할 수도 있다.
| |||
 Space-filling model
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Benzene[1] | |||
| 별칭
Benzol (historic/German)
Cyclohexa-1,3,5-triene; 1,3,5-Cyclohexatriene [6]Annulene (not recommended[1]) | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| EC 번호 |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C6H6 | |||
| 몰 질량 | 78.114 g·mol−1 | ||
| 겉보기 | 무색 액체 | ||
| 냄새 | sweet aromatic | ||
| 밀도 | 0.8765(20) g/cm3[2] | ||
| 녹는점 | 5.53 °C (41.95 °F; 278.68 K) | ||
| 끓는점 | 80.1 °C (176.2 °F; 353.2 K) | ||
| 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[3][4][5] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[6] | |||
| 용해도 | Soluble in 알코올, CHCl3, CCl4, 다이에틸 에터, 아세톤, 아세트산[6] | ||
| 에틸렌 글라이콜에서의 용해도 | 5.83 g/100 g (20 °C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[6] | ||
| 에탄올에서의 용해도 | 20 °C, solution in water: 1.2 mL/L (20% v/v)[7] | ||
| 아세톤에서의 용해도 | 20 °C, solution in water: 7.69 mL/L (38.46% v/v) 49.4 mL/L (62.5% v/v)[7] | ||
| 다이에틸렌 글라이콜에서의 용해도 | 52 g/100 g (20 °C)[6] | ||
| log P | 2.13 | ||
| 증기 압력 | 12.7 kPa (25 °C) 24.4 kPa (40 °C) 181 kPa (100 °C)[8] | ||
| 짝산 | Arenium ion | ||
| UV-vis (λmax) | 255 nm | ||
자화율 (χ)
|
−54.8·10−6 cm3/mol | ||
굴절률 (nD)
|
1.5011 (20 °C) 1.4948 (30 °C)[6] | ||
| 점도 | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| 구조 | |||
| Trigonal planar | |||
| 0 D | |||
| 열화학 | |||
열용량 (C)
|
134.8 J/mol·K | ||
표준 몰 엔트로피 (S
|
173.26 J/mol·K[8] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
48.7 kJ/mol | ||
표준 연소 엔탈피 (ΔcH⦵298)
|
3267.6 kJ/mol[8] | ||
| 위험 | |||
| 주요 위험 | potential occupational carcinogen, flammable | ||
| 물질 안전 보건 자료 | HMDB | ||
| GHS 그림문자 |      [9] [9]
| ||
| 신호어 | 위험 | ||
| H225, H304, H315, H319, H340, H350, H372, H410[9] | |||
| P201, P210, P301+310, P305+351+338, P308+313, P331[9] | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | −11.63 °C (11.07 °F; 261.52 K) | ||
| 497.78 °C (928.00 °F; 770.93 K) | |||
| 폭발 한계 | 1.2–7.8% | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
930 mg/kg (rat, oral) | ||
LCLo (lowest published)
|
44,000 ppm (rabbit, 30 min) 44,923 ppm (dog) 52,308 ppm (cat) 20,000 ppm (human, 5 min)[11] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
TWA 1 ppm, ST 5 ppm[10] | ||
REL (권장)
|
Ca TWA 0.1 ppm ST 1 ppm[10] | ||
IDLH (직접적 위험)
|
500 ppm[10] | ||
| 관련 화합물 | |||
관련 화합물
|
톨루엔 Borazine | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
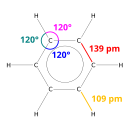
벤젠을 구성하는 6개의 탄소 원자는 서로 공유결합을 이루며, 6개의 탄소 원자 끝에 각각 1개의 수소 원자가 공유결합을 이루고 있다. 탄소 원자 간의 결합은 단일결합도, 이중결합도 아닌 중간적 성질을 가지며, 탄소원자 사이의 결합길이는 0.139nm로 모두 같다. 공명 구조를 이루고 있어 화학적으로 매우 안정하다. 벤젠은 무극성 분자이다.[12]
역사
편집발견
편집'Benzene'이라는 단어는 15세기부터 유럽의 약제사들과 향수 제조사들에게 동남아시아에서 생산된다고 알려졌던 향기나는 수지(樹脂) 'gum benzoin'에서 유래됐다. 'benzoin'이라는 말은 '자바 섬의 유향'이라는 뜻의 'luban jawi'가 전와된 것이다. benzoin으로부터 산성 물질이 승화를 통해 분리되었고, 이를 'flower of benzoin' 혹은 벤조산이라고 이름붙였다. 벤조산으로부터 분리된 탄화수소는 이리하여 '벤진(benzin)', '벤졸(benzol)' 혹은 '벤젠(benzene)'이라는 이름을 갖게 되었다.
벤젠의 구조
편집평면 정육각형구조를 이루고 있다. 결합길이는 여섯개로 모두 같고, 단일결합과 이중결합의 중간 정도의 길이이다. 공명 구조를 이루고 있기 때문에, 매우 불안정하여 공명 구조가 유지되지 않는 첨가반응보다는 공명구조가 유지되는 치환반응을 잘한다.
공명 구조
편집벤젠(C6H6)에 있어 탄소원자간의 결합길이가 단일결합은 0.154 nm, 이중결합은 0.134nm이나, 벤젠은 모두 0.140 nm 로 측정되고 있어, 흔히 알고 있는 6각형의 단일결합과 이중결합의 구조가 제대로 설명하고 있지 못한다. 따라서 단일결합과 이중결합의 중간인 1.53결합, 즉 공명 구조를 이루고 있는 것으로 알려져있고, 공명 구조를 가지는 경우 그렇지 않은 분자들에 비해 에너지가 낮아 안정한 구조이다.
벤젠의 구조를 표현하는 유니코드도 존재한다. [6]-아눌린 으로써의 유니코드는 U+232C (⌬) 공명구조는 U+23E3 (⏣)이다.
화학 반응
편집같이 보기
편집각주
편집- ↑ 가 나 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 10, 22, 204, 494, 577쪽. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ Lide, D. R., 편집. (2005). 《CRC Handbook of Chemistry and Physics》 86판. Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). “Solubility of Benzene in Water”. 《Industrial & Engineering Chemistry Chemical & Engineering Data Series》 3 (2): 253–256. doi:10.1021/i460004a016.
- ↑ Breslow, R.; Guo, T. (1990). “Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers”. 《Proceedings of the National Academy of Sciences of the United States of America》 87 (1): 167–9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221. PMID 2153285.
- ↑ Coker, A. Kayode; Ludwig, Ernest E. (2007). 《Ludwig's Applied Process Design for Chemical And Petrochemical Plants》 1. Elsevier. 114쪽. ISBN 978-0-7506-7766-0. 2012년 5월 31일에 확인함.
- ↑ 가 나 다 라 마 “Benzol”.
- ↑ 가 나 Atherton Seidell; William F. Linke (1952). 《Solubilities of Inorganic and Organic Compounds: A Compilation of Solubility Data from the Periodical Literature. Supplement》. Van Nostrand.
- ↑ 가 나 다 Benzene in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (retrieved 2014-05-29)
- ↑ 가 나 다 Sigma-Aldrich Co., Benzene. Retrieved on 2014-05-29.
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0049”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ “Benzene”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 김봉래 외 2 (2006년 7월 1일). 《완자 화학 Ⅰ(1권)》 초판. 비유와상징. 9쪽.
외부 링크
편집- (영어) Benzene