글루코스 6-포스파테이스
포도당 6-인산가수분해효소(영어: glucose 6-phosphatase, G6Pase) (EC 3.1.3.9)는 다음과 같이 포도당 6-인산을 가수분해하여 포도당과 인산을 생성하는 화학 반응을 촉매하는 효소이다. 글루코스 6-포스파테이스, 포도당 6-포스파테이스라고도 한다. 포도당 6-인산가수분해효소의 계통명은 D-포도당 6-인산 포스포하이드롤레이스(영어: D-glucose-6-phosphate phosphohydrolase)이다.

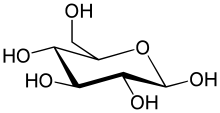
- D-포도당 6-인산 + H2O ⇄ D-포도당 + 인산
그런 다음 포도당은 포도당 수송체를 통해 세포로부터 내보내진다.[1] 이 촉매작용은 포도당신생합성의 마지막 단계이기 때문에 혈당량의 항상성 조절에 중요한 역할을 한다.[2]
포도당 6-인산가수분해효소는 포도당 6-인산(G6P), 포도당 및 인산에 대한 수송체를 포함하는 다중 성분 단백질 복합체이다. 주요 인산가수분해효소의 기능은 포도당 6-인산가수분해효소 촉매 소단위체에 의해 수행된다. 사람에서는 G6PC에 의해 암호화되는 포도당 6-인산가수분해효소-α, G6PC2에 의해 암호화되는 IGRP, G6PC3에 의해 암호화되는 포도당 6-인산가수분해효소-β라는 촉매 소단위체의 세 가지 동질효소이다.[3]
포도당 6-인산가수분해효소-α 및 포도당 6-인산가수분해효소-β는 둘 다 기능성 포스포하이드롤레이스이며, 포도당 6-인산(G6P)의 가수분해와 관련하여 유사한 활성 부위 구조, 위상 배치, 작용 메커니즘 및 반응속도론적 특성을 가지고 있다.[4] 대조적으로 IGRP는 가수분해효소 활성이 거의 없으며, 이자의 인슐린 분비를 자극하는 데 다른 역할을 할 수 있다.[5]
구조와 기능
편집명확한 합의가 이루어지지는 않았지만 많은 과학자들이 포도당 6-인산가수분해효소의 촉매적 특성을 설명하기 위해 기질-수송 모델을 고수하고 있다. 이 모델에서 포도당 6-인산가수분해효소는 낮은 정도의 선택성을 갖는다. 포도당 6-인산의 전달은 수송체 단백질(T1)에 의해 수행되고 소포체(ER)는 인산기(T2)와 포도당(T3)의 출구를 허용하는 구조를 포함한다.[6]
포도당 6-인산가수분해효소는 357개의 아미노산으로 구성되어 있으며 9개의 막횡단 나선에 의해 소포체에 고정된다. 포도당 6-인산가수분해효소의 N-말단과 활성 부위는 소포체의 내강 쪽에서 발견되며 C-말단은 세포질 쪽으로 돌출된다. 소포체와 긴밀하게 연관되어 있기 때문에 포도당 6-인산가수분해효소의 정확한 구조는 아직 알려지지 않았다. 그러나 서열 정렬은 포도당 6-인산가수분해효소가 쿠르불라리아 이나에쿠알리스(Curvularia inaequalis)에서 발견되는 바나듐 함유 염화물 과산화효소의 활성 부위와 구조적으로 유사하다는 것을 보여주었다.[7]
포도당 6-인산가수분해효소-α 촉매 작용의 pH 반응속도론적 연구에 기초하여, 포도당 6-인산의 가수분해는 공유결합된 포스포히스티딘 포도당 6-인산 중간생성물을 통해 완료된다고 제안되었다. 포도당 6-인산가수분해효소-α의 활성 부위는 지질 인산가수분해효소, 산 인산가수분해효소, 바나듐 할로퍼옥시데이스에서 일반적으로 발견되는 보존된 인산 시그니처 모티프의 존재에 의해 처음으로 확인되었다.[4]
바나듐 할로퍼옥시데이스의 활성 부위에 있는 필수 잔기에는 Lys353, Arg360, Arg490, His404, His496이 포함된다. 포도당 6-인산가수분해효소-α의 활성 부위에 상응하는 잔기는 인산에 수소 이온을 제공하여 전이 상태를 안정화시키는 Arg170 및 Arg83, 포도당에 부착된 탈인산화된 산소에 양성자를 제공하는 His119와 인산에 대한 친핵성 공격을 완료하여 공유결합된 인산 효소 중간생성물을 형성하는 His176이 포함된다.[1] 바나듐 함유 염화물 과산화효소 내에서 Lys353은 전이 상태에서 인산을 안정화시키는 것으로 밝혀졌다. 그러나 포도당 6-인산가수분해효소-α에서 상응하는 잔기(Lys76)은 소포체 막 내에 존재하며, 존재하는 경우 그 기능은 현재 결정되지 않았다. Lys76을 제외하고 이러한 잔기들은 모두 소포체 막의 내강 쪽에 위치한다.[4]
포도당 6-인산가수분해효소-β는 포도당 6-인산가수분해효소-α와 36%의 서열 상동성을 공유하는 편재적으로 발현되는 346개의 아미노산들로 구성된 막 단백질이다. 포도당 6-인산가수분해효소-β 내에서 서열 정렬은 활성 부위가 His167, His114 및 Arg79를 포함하는 것으로 예측한다. 포도당 6-인산가수분해효소-α의 활성 부위와 유사하게, His167은 친핵성 공격을 제공하는 잔기이고, His114 및 Arg79는 수소 공여체이다. 포도당 6-인산가수분해효소-β는 또한 소포체 막에 국한되어 있지만 그 배열 방향은 알려져 있지 않다.[4]
메커니즘
편집포도당 6-인산의 가수분해는 His176에 의한 당 결합 인산에 대한 친핵성 공격으로 시작되어 포스포히스티딘 결합의 형성과 카보닐기의 분해를 초래한다. 음으로 하전된 산소는 전자를 전달하여 카보닐기를 재형성하고 포도당과의 결합을 끊는다. 음으로 하전된 포도당 결합 산소는 유리 포도당을 형성하는 His119에 의해 양성자화된다. His176과 인산기 사이의 반응에 의해 생성된 인산 중간생성물은 친수성 공격에 의해 분해된다. 다른 수산화물을 첨가하고 카보닐기를 분해한 후, 카보닐기는 원래 His176 잔기에 의해 공여된 전자를 방출하면서 개질되어 유리 인산기를 생성하고 가수분해를 완료한다.[1]
발현
편집포도당 6-인산가수분해효소를 암호화하는 유전자는 주로 간, 콩팥 겉질에서 발현되며 랑게르한스섬의 β 세포 및 장 점막(특히 기아 기간 동안)에서는 덜 발현된다.[6] 서홀트(Surholt)와 뉴스홈(Newsholme)에 따르면 포도당 6-인산가수분해효소는 매우 낮은 농도에도 불구하고 동물계의 다양한 근육에 존재한다.[8] 따라서 근육이 저장하는 글리코젠은 일반적으로 나머지 신체 세포에서 사용할 수 없다. 왜냐하면 포도당 6-인산은 탈인산화되지 않는 한 근섬유막을 통과할 수 없기 때문이다. 포도당 6-인산가수분해효소는 단식 기간과 포도당 수치가 낮을 때 중요한 역할을 한다. 기아와 당뇨병은 간에서 포도당 6-인산가수분해효소의 활성을 2~3배 정도 증가시키는 것으로 나타났다.[6] 포도당 6-인산가수분해효소의 활성은 또한 생물체가 모체의 포도당 공급원으로부터 독립하게 되는 출생시에 극적으로 증가한다. 사람의 포도당 6-인산가수분해효소 유전자는 염색체 17q21에 위치한 DNA에 대략 125.5 kb로 걸쳐 있는 5개의 엑손을 포함한다.[9]
임상적 중요성
편집포도당 6-인산가수분해효소의 돌연변이, 구체적으로 포도당 6-인산가수분해효소-α 소단위체(포도당 6-인산가수분해효소-α) 포도당 6-수송체(G6PT), 포도당 6-인산가수분해효소-β 소단위체(포도당 6-인산가수분해효소-β 또는 G6PC3)는 식사 사이의 포도당 항상성 및 호중구 기능 및 항상성 유지의 결핍을 초래한다.[10][11] 포도당 6-인산가수분해효소-α 및 G6PT 둘 다의 돌연변이는 글리코젠 축적병 I형(GSD I, 폰기에르케병)을 유발한다.[12] 구체적으로 말하면, 포도당 6-인산가수분해효소-α의 돌연변이는 간 및 콩팥에 글리코젠 및 지방이 축적되어 간비대 및 신장비대를 초래하는 것을 특징으로 하는 글리코젠 축적병 Ia형으로 이어진다.[13] 글리코젠 축적병 Ia형(GSD Ia)은 임상적으로 나타나는 글리코젠 축적병 I형(GSD I) 사례의 약 80%를 차지한다.[14] 포도당 6-수송체(G6PT)의 부재는 글리코젠 축적병 Ib형(GSD Ib)로 이어지며, 이는 G6PT의 결핍을 특징으로 하며 임상적으로 존재하는 사례의 20%를 차지한다.[14][15]
글리코젠 축적병 Ia형(GSD Ia)의 특정 원인은 넌센스 돌연변이, 해독틀의 이동이 있거나 없는 삽입/결실 또는 유전자 수준에서 일어나는 스플라이스 부위 돌연변이에서 비롯된다.[6] 과오 돌연변이는 포도당 6-인산가수분해효소-α의 두 개의 큰 내강 루프와 막횡단 나선에 영향을 주어 효소의 활성을 없애거나 크게 감소시킨다.[6] 글리코젠 축적병 Ib형(GSD Ib)의 특정 원인은 스플라이스 부위 돌연변이, 틀이동 돌연변이 및 포도당 6-수송체(G6PT)의 활성을 완전히 파괴하는 고도로 보존된 잔기의 치환과 같은 심각한 돌연변이에서 비롯된다.[6] 이러한 돌연변이는 포도당 6-인산(G6P)이 소포체 내강으로 이동하는 것을 방지하고 포도당 6-인산이 세포에서 사용되는 포도당으로 전환되는 것을 억제함으로써 글리코젠 축적병 I형(GSD I)의 발병을 초래한다.
포도당 6-인산가수분해효소 결핍증의 세 번째 유형인 포도당 6-인산가수분해효소-β 결핍은 호중구가 강화된 소포체 스트레스, 증가된 세포자멸사, 손상된 에너지 항상성 및 손상된 기능을 나타내는 선천성 호중구감소증을 특징으로 한다.[16] 또한 심장 및 비뇨생식기 기형을 유발할 수 있다.[17] 포도당 6-인산가수분해효소-β도 소포체 내강 내에 있기 때문에 이러한 세 번째 유형의 결핍증은 포도당 6-수송체(G6PT) 결핍의 영향을 받으며, 따라서 포도당 6-인산가수분해효소-β 결핍이 글리코젠 축적병 Ib형(GSD Ib)과 관련된 유사한 증상을 초래할 수 있다.[15] 더욱이 최근의 연구는 두 결핍 사이의 유사한 영역을 설명하고 비정상적인 글리코실화가 두 결핍에서 일어남을 보여주었다.[18] 호중구의 글리코실화는 호중구의 활성에 중대한 영향을 미치므로 선천적인 글리코실화 장애로도 분류할 수 있다.[18]
포도당 6-인산가수분해효소-β의 주요 기능은 정상 기능을 유지하기 위해 호중구의 세포질에 재활용된 포도당을 제공하는 것으로 결정되었다. 세포 내 포도당 수치의 현저한 감소로 인한 포도당 대 포도당 6-인산 비율의 붕괴는 해당과정과 오탄당 인산 경로에 상당한 장애를 야기한다.[11] 세포 외 포도당의 흡수에 의해 상쇄되지 않는 한 이러한 결핍은 호중구의 기능 장애를 유발한다.[11]
황산 바나딜과 같은 바나듐 화합물은 효소를 저해하여 잠재적인 치료 의미를 가질 수 있는 고인슐린혈증 클램프 기술에 의해 평가된 바와 같이 당뇨병 환자의 생체 내 인슐린 감수성을 증가시키는 것으로 나타났다.[19][20]
같이 보기
편집주해
편집분자 그래픽 이미지는 UCSF 키메라를 사용하여 생성되었다.[21]
각주
편집- ↑ 가 나 다 Ghosh A, Shieh JJ, Pan CJ, Sun MS, Chou JY (September 2002). “The catalytic center of glucose-6-phosphatase. HIS176 is the nucleophile forming the phosphohistidine-enzyme intermediate during catalysis”. 《The Journal of Biological Chemistry》 277 (36): 32837–42. doi:10.1074/jbc.M201853200. PMID 12093795.
- ↑ Nordlie R, 외. (1985). 《The Enzymes of biological membranes, 2nd edition》. New York: Plenum Press. 349–398쪽. ISBN 0-306-41453-8.
- ↑ Hutton JC, O'Brien RM (October 2009). “Glucose-6-phosphatase catalytic subunit gene family”. 《The Journal of Biological Chemistry》 284 (43): 29241–5. doi:10.1074/jbc.R109.025544. PMC 2785553. PMID 19700406.
- ↑ 가 나 다 라 Ghosh A, Shieh JJ, Pan CJ, Chou JY (March 2004). “Histidine 167 is the phosphate acceptor in glucose-6-phosphatase-β forming a phosphohistidine enzyme intermediate during catalysis”. 《The Journal of Biological Chemistry》 279 (13): 12479–83. doi:10.1074/jbc.M313271200. PMID 14718531.
- ↑ Shieh JJ, Pan CJ, Mansfield BC, Chou JY (September 2005). “In islet-specific glucose-6-phosphatase-related protein, the β cell antigenic sequence that is targeted in diabetes is not responsible for the loss of phosphohydrolase activity”. 《Diabetologia》 48 (9): 1851–9. doi:10.1007/s00125-005-1848-6. PMID 16012821.
- ↑ 가 나 다 라 마 바 van Schaftingen E, Gerin I (March 2002). “The glucose-6-phosphatase system”. 《The Biochemical Journal》 362 (Pt 3): 513–32. doi:10.1042/0264-6021:3620513. PMC 1222414. PMID 11879177.
- ↑ Pan CJ, Lei KJ, Annabi B, Hemrika W, Chou JY (March 1998). “Transmembrane topology of glucose-6-phosphatase”. 《The Journal of Biological Chemistry》 273 (11): 6144–8. doi:10.1074/jbc.273.11.6144. PMID 9497333.
- ↑ Surholt, B; Newsholme, EA (1981년 9월 15일). “Maximum activities and properties of glucose 6-phosphatase in muscles from vertebrates and invertebrates.”. 《The Biochemical Journal》 198 (3): 621–9. doi:10.1042/bj1980621. PMC 1163310. PMID 6275855.
- ↑ Angaroni CJ, de Kremer RD, Argaraña CE, Paschini-Capra AE, Giner-Ayala AN, Pezza RJ, Pan CJ, Chou JY (November 2004). “Glycogen storage disease type Ia in Argentina: two novel glucose-6-phosphatase mutations affecting protein stability”. 《Molecular Genetics and Metabolism》 83 (3): 276–9. doi:10.1016/j.ymgme.2004.06.010. PMID 15542400.
- ↑ Chou JY, Jun HS, Mansfield BC (December 2010). “Glycogen storage disease type I and glucose-6-phosphatase-β deficiency: etiology and therapy”. 《Nature Reviews. Endocrinology》 6 (12): 676–88. doi:10.1038/nrendo.2010.189. PMC 4178929. PMID 20975743.
- ↑ 가 나 다 Jun HS, Lee YM, Cheung YY, McDermott DH, Murphy PM, De Ravin SS, Mansfield BC, Chou JY (October 2010). “Lack of glucose recycling between endoplasmic reticulum and cytoplasm underlies cellular dysfunction in glucose-6-phosphatase-β-deficient neutrophils in a congenital neutropenia syndrome”. 《Blood》 116 (15): 2783–92. doi:10.1182/blood-2009-12-258491. PMC 2974586. PMID 20498302.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2007). 《Biochemistry》. San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- ↑ Pagon RA, Bird TD, Dolan CR, 외. (1993). “Glycogen Storage Disease Type I”. PMID 20301489.
- ↑ 가 나 Chou JY, Matern D, Mansfield BC, Chen YT (March 2002). “Type I glycogen storage diseases: disorders of the glucose-6-phosphatase complex”. 《Current Molecular Medicine》 2 (2): 121–43. doi:10.2174/1566524024605798. PMID 11949931.
- ↑ 가 나 Froissart R, Piraud M, Boudjemline AM, Vianey-Saban C, Petit F, Hubert-Buron A, Eberschweiler PT, Gajdos V, Labrune P (2011). “Glucose-6-phosphatase deficiency”. 《Orphanet Journal of Rare Diseases》 6: 27. doi:10.1186/1750-1172-6-27. PMC 3118311. PMID 21599942.
- ↑ Jun HS, Lee YM, Song KD, Mansfield BC, Chou JY (April 2011). “G-CSF improves murine G6PC3-deficient neutrophil function by modulating apoptosis and energy homeostasis”. 《Blood》 117 (14): 3881–92. doi:10.1182/blood-2010-08-302059. PMC 3083300. PMID 21292774.
- ↑ Boztug K, Appaswamy G, Ashikov A, Schäffer AA, Salzer U, Diestelhorst J, Germeshausen M, Brandes G, Lee-Gossler J, Noyan F, Gatzke AK, Minkov M, Greil J, Kratz C, Petropoulou T, Pellier I, Bellanné-Chantelot C, Rezaei N, Mönkemöller K, Irani-Hakimeh N, Bakker H, Gerardy-Schahn R, Zeidler C, Grimbacher B, Welte K, Klein C (Jan 2009). “A syndrome with congenital neutropenia and mutations in G6PC3”. 《The New England Journal of Medicine》 360 (1): 32–43. doi:10.1056/NEJMoa0805051. PMC 2778311. PMID 19118303.
- ↑ 가 나 Hayee B, Antonopoulos A, Murphy EJ, Rahman FZ, Sewell G, Smith BN, McCartney S, Furman M, Hall G, Bloom SL, Haslam SM, Morris HR, Boztug K, Klein C, Winchester B, Pick E, Linch DC, Gale RE, Smith AM, Dell A, Segal AW (July 2011). “G6PC3 mutations are associated with a major defect of glycosylation: a novel mechanism for neutrophil dysfunction”. 《Glycobiology》 21 (7): 914–24. doi:10.1093/glycob/cwr023. PMC 3110488. PMID 21385794.
- ↑ “Effects of vanadyl sulfate on carbohydrate and lipid metabolism in patients with non—insulin-dependent diabetes mellitus - Metabolism - Clinical and Experimental”. 《www.metabolismjournal.com》. 2015년 6월 16일에 확인함.
- ↑ Shehzad, Saima (2013년 1월 1일). “The potential effect of vanadium compounds on glucose-6-phosphatase”. 《Bioscience Horizons》 6: hzt002. doi:10.1093/biohorizons/hzt002. ISSN 1754-7431.
- ↑ Pettersen EF, Goddard TD, Huang CC, Couch GS, Greenblatt DM, Meng EC, Ferrin TE (October 2004). “UCSF Chimera--a visualization system for exploratory research and analysis” (PDF). 《Journal of Computational Chemistry》 25 (13): 1605–12. doi:10.1002/jcc.20084. PMID 15264254. S2CID 8747218.