수용체
수용체(受容體, 영어: receptor)는 생화학 및 약리학에서 생물학적 시스템에 통합될 수 있는 신호를 수신하고 전달하는 단백질로 구성된 화학적 구조이다.[1] 이러한 신호는 일반적으로 수용체와 결합하여 세포의 전기적 활성의 변화와 같은 생리학적 반응을 생성하는 화학적 전달자이다.[주 1] 예를 들어, 억제성 신경전달물질인 GABA는 GABAA 수용체와 결합하여 뉴런의 전기적 활성을 억제한다.[2] 수용체의 작용은 신호의 중계, 증폭, 통합이라는 세 가지 주요 방법으로 분류될 수 있다.[3] 중계는 신호를 앞으로 내보내고, 증폭은 단일 리간드의 효과를 증가시키며, 통합을 위해 신호가 다른 생화학적 경로에 통합될 수 있다.[3]
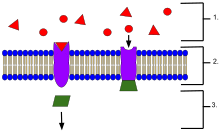
- 세포 외부에 위치한 리간드
- 리간드는 단백질의 활성 부위의 모양에 따라 특정 수용체 단백질에 결합한다.
- 리간드가 수용체에 결합하면 수용체는 전달자를 방출한다.
수용체 단백질은 위치에 따라 분류할 수 있다. 막관통 수용체라고도 알려진 세포 표면 수용체에는 리간드 개폐 이온 통로, G 단백질 연결 수용체, 효소 연결 수용체가 있다.[1] 세포내 수용체는 세포 내부에서 발견되는 수용체로, 세포질 수용체와 핵 수용체가 있다.[1] 수용체에 결합하는 분자를 리간드라고 하며 단백질, 펩타이드(길이가 짧은 단백질) 또는 신경전달물질, 호르몬, 의약품, 독소, 칼슘 이온, 바이러스나 미생물 외부의 일부와 같은 다른 저분자일 수 있다. 특정 수용체에 결합하는 내인성 생성 물질을 내인성 리간드라고 한다. 예를 들어, 니코틴성 아세틸콜린 수용체에 대한 내인성 리간드는 아세틸콜린이지만, 이는 니코틴에 의해 활성화되고[4][5] 큐라레의 의해 차단될 수도 있다.[6] 특정 유형의 수용체는 신호에 해당하는 특정 생화학적 경로에 연결된다. 대부분의 세포에는 수많은 수용체가 발견되지만 각 수용체는 특정 구조의 리간드에만 결합한다. 이는 효소에서의 자물쇠-열쇠 모델과 유사하게 비교되었다. 리간드가 해당 수용체에 결합하면 수용체와 곤련된 생화학적 경로(또한 고도로 전문화될 수 있음)를 활성화하거나 억제한다.
수용체 단백질은 리간드의 특성에 따라 분류할 수도 있다. 이러한 분류에는 화학수용체, 기계수용체, 중력수용체, 광수용체, 자기수용체, 기체수용체가 포함된다.
구조
편집수용체의 구조는 매우 다양하며, 특히 다음과 같은 주요 부류로 나눌 수 있다.
- 유형 1: 리간드 개폐 이온 통로 (이온성 수용체) – 리간드 개폐 이온 통로는 일반적으로 아세틸콜린(니코틴성) 및 γ-아미노뷰티르산(GABA)과 같은 전달 속도가 빠른 신경전달물질의 표적이다. 이들 수용체의 활성화는 막을 가로지르는 이온 이동의 변화를 초래한다. 이들은 각 소단위체가 세포외 리간드 결합 도메인과 4개의 막관통 α-나선을 포함하는 막관통 도메인으로 구성된다는 점에서 헤테로머(heteromer) 구조를 가지고 있다. 리간드 결합 공동(cavity)은 소단위체 사이의 경계면에 위치한다.
- 유형 2: G 단백질 연결 수용체 (대사성 수용체) – G 단백질 연결 수용체는 수용체의 가장 큰 패밀리이며, 여러 호르몬과 전달 속도가 느린 신경전달물질(예: 도파민, 대사성 글루탐산)의 표적이다. G 단백질 연결 수용체는 7개의 막관통 α 나선으로 구성된다. α 나선을 연결하는 루프는 세포외 도메인과 세포내 도메인을 형성한다. 더 큰 펩타이드 리간드의 결합 부위는 일반적으로 세포외 도메인에 위치하는 반면, 더 작은 비펩타이드 리간드의 결합 부위는 보통 7개의 α 나선과 1개의 세포외 루프 사이에 위치한다.[7] 앞서 언급한 수용체는 G 단백질을 통해 다양한 세포내 효과기 시스템에 연결된다.[8] G 단백질은 α, β, γ의 3가지 소단위체로 구성된 이종삼량체이다. 비활성 상태에서 3가지 소단위체는 함께 결합해 있고 α 소단위체는 GDP와 결합해 있다.[9] G 단백질의 활성화는 입체구조적 변화를 일으키고, 이는 GDP를 GTP로 교환되도록 한다. α 소단위체가 GTP와 결합하면 α 소단위체는 β 소단위체와 γ 소단위체와 분리된다.[10] 또한, 3가지 소단위체인 α, β, γ 소단위체는 1차 서열에 따라 4가지 주요 부류로 추가적으로 나눌 수 있다. 여기에는 Gs, Gi, Gq, G12가 포함된다.[11]
- 유형 3: 효소 연결 수용체 (수용체 티로신 키네이스 및 키네이스 연결 수용체 및 키네이스 관련 수용체를 참조) – 효소 연결 수용체는 리간드 결합 부위를 포함하는 세포외 도메인과 단일 막관통 α 나선으로 연결된 종종 효소 기능을 갖는 세포내 도메인으로 구성된다. 예로는 인슐린 수용체가 있다.
- 유형 4: 핵 수용체 – 핵 수용체라고 불리지만 이들은 실제로는 세포질에 위치하며 리간드와 결합한 후 핵으로 이동한다. 핵 수용체는 C-말단 리간드 결합 영역, 핵심 DNA 결합 도메인, AF1(활성화 기능 1) 영역을 포함하는 N-말단 도메인으로 구성된다. 핵심 영역에는 이 수용체에 특정한 DNA 서열을 인식하는 역할을 하는 두 개의 아연 핑거가 있다. N-말단은 리간드 비의존적 방식으로 다른 세포의 전사인자와 상호작용을 한다. 그리고 이러한 상호작용에 따라 수용체의 결합/활성을 변형할 수 있다. 스테로이드 호르몬 수용체와 갑상샘 호르몬 수용체가 그러한 수용체의 예이다.[12]
막 수용체는 용매, 계면활성제 및 친화성 정제를 사용하는 복잡한 추출 절차를 통해 세포막으로부터 분리될 수 있다.
수용체의 구조와 작용은 X선 결정학, 핵자기 공명(NMR), 원편광 이색성, 이중 편파 간섭법과 같은 생물물리학적 방법을 사용하여 연구할 수 있다. 수용체의 동적 행동에 대한 컴퓨터 시뮬레이션을 사용하여 수용체의 작용 메커니즘을 이해할 수 있게 되었다.
결합 및 활성화
편집리간드의 결합은 화학 평형 과정이다. 리간드는 리간드 L과 수용체 R에 대해 다음의 방정식에서 질량작용의 법칙에 따라 수용체에 결합하고 분리된다. 화학종에 표시된 대괄호는 해당 화학종의 농도를 나타낸다.
리간드가 수용체에 얼마나 잘 들어맞는지를 측정하는 한 가지 방법은 결합 친화도를 측정하는 것이며, 이는 해리 상수 Kd에 반비례한다. 리간드가 높은 친화력과 낮은 Kd 값을 가질수록 수용체에 더 잘 결합한다. 최종적인 생물학적 반응(예: 2차 전달자 캐스케이드, 근육 수축)은 상당한 수의 수용체가 활성화된 후에만 달성된다.
친화도(affinity)는 리간드가 수용체에 결합하는 경향을 측정한 것이다. 효능(efficacy)은 수용체를 활성화하기 위해 결합된 리간드를 측정하는 것이다.
작용제 및 길항제
편집수용체에 결합하는 모든 리간드가 해당 수용체를 활성화시키는 것은 아니다. 다음과 같은 종류의 리간드가 존재한다.
- (완전) 작용제는 수용체를 활성화시켜 강력한 생물학적 반응을 일으킬 수 있다. 주어진 수용체에 대해 가장 큰 효능을 갖는 천연 내인성 리간드는 정의에 따라 완전 작용제(100% 효능)이다.
- 부분 작용제는 최대 결합을 하더라도 최대 효능으로 수용체를 활성화시키지 않아 완전 작용제에 비해 부분적인 반응을 유발한다(효능 0~100%).
- 길항제는 수용체에 결합하지만 수용체를 활성화시키지 않는다. 이는 수용체 차단을 초래하여 작용제와 역작용제의 결합을 억제한다. 수용체 길항제는 경쟁적(또는 가역적)일 수 있으며 수용체에 대한 작용제와 경쟁할 수도 있고, 수용체와 공유 결합(또는 매우 높은 친화력의 비공유 결합)을 형성하여 이를 완전히 차단하는 비가역적 길항제일 수도 있다. 양성자 펌프 저해제인 오메프라졸은 비가역적 길항제의 예이다. 비가역적 길항작용의 효과는 새로운 수용체의 합성에 의해서만 되돌릴 수 있다.
- 역작용제는 구성적 활성을 저해하여 수용체의 활성을 감소시킨다(음성 효능).
- 알로스테릭 조절인자는 수용체의 작용제 결합 부위에 결합하지 않고 대신 특정 알로스테릭 결합 부위에 결합하여 작용제의 효과를 변형시킨다. 예를 들어, 벤조다이아제핀(BZD)은 GABAA 수용체의 BZD 부위에 결합하여 내인성 GABA의 효과를 강화한다.
수용체 작용과 길항작용의 개념은 수용체와 리간드 사이의 상호작용만을 의미하며 생물학적 효과를 의미하지 않는다는 점에 유의해야 한다.
구성적 활성
편집리간드의 결합이 없이도 생물학적 반응을 생성할 수 있는 수용체는 "구성적 활성"을 나타낸다고 한다.[13] 수용체의 구성적 활성은 역작용제에 의해 차단될 수 있다. 항비만제인 리모나반트와 타라나반트는 칸나비노이드 수용체 1(CB1)의 역작용제이며 상당한 체중 감소를 가져왔지만 우울증과 불안의 높은 발생률로 인해 둘 다 사용이 중단되었다. 이는 칸나비노이드 수용체의 구성적 활성 저해와 관련이 있는 것으로 여겨진다.
GABAA 수용체는 구성적 활성을 가지며 작용제가 없을 때 일부 기본적인 흐름을 처리한다. 이를 통해 β-카르볼린은 역작용제로 작용하여 흐름을 기본 수준 이하로 감소시킬 수 있다.
구성적 활성을 증가시키는 수용체의 돌연변이는 성조숙증(황체형성 호르몬 수용체의 돌연변이로 인해) 및 갑상샘 기능 항진증(갑상샘 자극 호르몬(TSH) 수용체의 돌연변이로 인해)과 같은 일부 유전 질환의 원인이 된다.
약물-수용체 상호작용의 이론
편집점유
편집약리학에서 수용체 이론의 초기 형태는 약물의 효과가 점유된 수용체의 수에 정비례한다고 명시했다.[14] 더욱이, 약물-수용체 복합체가 해리됨에 따라 약물 효과가 중단된다.
아리엔스와 스티븐슨(Stephenson)은 수용체에 결합된 리간드의 작용을 설명하기 위해 친화도(affinity) 및 효능(efficacy)이라는 용어를 도입했다.[15][16]
속도
편집수용된 점유 이론과 대조적으로 속도 이론은 수용체의 활성화가 단위 시간 당 약물과 수용체의 총 접촉 횟수에 정비례한다고 제안한다. 약리학적 활성은 점유된 수용체의 수가 아니라 해리 및 결합 속도에 정비례한다.[17]
- 작용제: 빠른 결합과 빠른 해리를 보이는 약물이다.
- 부분 작용제: 중간적인 속도의 결합과 중간적인 속도의 해리를 보이는 약물이다.
- 길항제: 빠른 결합과 느린 해리를 보이는 약물이다.
유도 적합
편집약물이 수용체에 결합하면 수용체의 결합 부위의 입체구조가 변화하여 약물-수용체 복합체가 생성된다.
예비 수용체
편집일부 수용체 시스템(예: 평활근의 신경근 접합부에 있는 아세틸콜린)에서 작용제는 매우 낮은 수준의 수용체 점유율(<1%)에서 최대 반응을 유도할 수 있다. 따라서 해당 시스템에는 예비 수용체가 있다. 이러한 배열은 신경전달물질의 생성 및 방출의 경제성을 창출한다.[12]
수용체 조절
편집세포는 특정 호르몬이나 신경전달물질에 대한 수용체의 수를 늘리거나(상향조절) 감소시켜(하향조절) 다른 분자에 대한 민감도를 변경할 수 있다. 이는 국지적으로 작동하는 피드백 메커니즘이다.
- 작용제의 결합이 수용체를 활성화시키지 않도록 수용체의 입체구조적 변화가 일어난다. 이는 이온 통로 연결 수용체에서 볼 수 있다.
- 수용체 효과인자의 분리는 G 단백질 연결 수용체에서 나타난다.
- 수용체 격리 (내재화)[18] (예: 호르몬 수용체의 경우)
예시 및 리간드
편집수용체에 대한 리간드는 수용체만큼 다양하다. G 단백질 연결 수용체는 특히 구성원이 810개 이상인 대규모 패밀리이다. 또한 적어도 12가지의 내인성 리간드에 대한 리간드 개폐 이온 통로가 있으며, 다양한 소단위체 구성을 통해 더 많은 종류의 수용체가 가능하다. 리간드 및 수용체의 일반적인 예는 다음과 같다.[19]
이온 통로 연결 수용체
편집이온성 수용체(리간드 개폐 이온 통로)의 몇 가지 예가 아래의 표에 나타나 있다. 주요 신경전달물질은 글루탐산과 GABA이다. 다른 신경전달물질은 신경조절성이다. 이 목록은 결코 완전한 것이 아니다.
| 내인성 리간드 | 이온 통로 연결 수용체 (리간드 개폐 이온 통로) | ||
|---|---|---|---|
| 수용체 | 이동하는 이온[주 2] | 외인성 리간드 | |
| 글루탐산 | 이온성 글루탐산 수용체: NMDA 수용체, AMPA 수용체, 카인산 수용체 |
Na+, K+, Ca2+[19] | 케타민 |
| GABA | GABAA 수용체 (GABAA-로 수용체 포함) |
Cl− > HCO−3[19] | 벤조다이아제핀 |
| 아세틸콜린 | 니코틴성 아세틸콜린 수용체 | Na+, K+, Ca2+[19] | 니코틴 |
| 글리신 | 글리신 수용체 (GlyR) | Cl− > HCO−3[19] | 스트리크닌 |
| 세로토닌 | 5-HT3 수용체 | Na+, K+[19] | 세레울라이드 |
| ATP | P2X 수용체 | Ca2+, Na+, Mg2+[19] | BzATP |
| 도파민 | 해당 이온 통로 없음 | – | – |
G 단백질 연결 수용체
편집대사성 수용체(특히, G 단백질 연결 수용체)의 몇 가지 예가 아래의 표에 나타나 있다. 주요 신경전달물질은 글루탐산과 GABA이다. 다른 신경전달물질은 신경조절성이다. 이 목록은 결코 완전한 것이 아니다.
| 내인성 리간드 | G 단백질 연결 수용체 | ||
|---|---|---|---|
| 수용체 | G 단백질 | 외인성 리간드 | |
| 글루탐산 | 글루탐산 수용체: 대사성 글루탐산 수용체 | Gq 또는 Gi/o | – |
| GABA | GABAB 수용체 | Gi/o | 바클로펜 |
| 아세틸콜린 | 무스카린성 아세틸콜린 수용체 | Gq 또는 Gi | 무스카린 |
| 글리신 | – | – | – |
| 세로토닌 | 5-HT1-2 또는 4-7 | Gs, Gi/o 또는 Gq | – |
| ATP | P2Y 수용체 | Gs, Gi/o 또는 Gq | – |
| 도파민 | 도파민 수용체 | Gs 또는 Gi/o | – |
효소 연결 수용체
편집효소 연결 수용체에는 수용체 티로신 키네이스(RTK), 세린/트레오닌 특이적 단백질 키네이스(뼈형성 단백질의 경우), 구아닐산 고리화효소(심방 나트륨이뇨 인자 수용체의 경우)가 포함된다. 수용체 티로신 키네이스(RTK) 중 20개의 부류가 식별되었으며, 58개의 서로 다른 RTK가 구성원으로 포함된다. 몇 가지 예가 다음과 같이 아래에 표시되어 있다.
| RTK 부류/수용체 패밀리 | 구성원 | 내인성 리간드 | 외인성 리간드 |
|---|---|---|---|
| I | 상피 성장인자 수용체(EGFR) | 상피 성장인자(EGF) | 게피티닙 |
| II | 인슐린 수용체 | 인슐린 | 채토크로민 |
| IV | 혈관내피 성장인자 수용체(VEGFR) | 혈관내피 성장인자(VEGF) | 렌바티닙 |
세포내 수용체
편집수용체는 메커니즘이나 세포 내 위치에 따라 분류할 수 있다. 세포내 리간드 개폐 이온 통로(LGIC)의 4가지 예는 다음과 같다.
| 수용체 | 리간드 | 이동하는 이온 |
|---|---|---|
| 고리형 뉴클레오타이드 개폐 이온 통로 | cGMP(시각), cAMP 및 GTP(후각) | Na+, K+[19] |
| 이노시톨 삼중인산 수용체(IP3 수용체) | 이노시톨 삼중인산(IP3) | Ca2+[19] |
| 세포내 ATP 수용체 | ATP(통로를 닫음)[19] | K+[19] |
| 리아노딘 수용체 | Ca2+ | Ca2+[19] |
건강 및 질병에서의 역할
편집유전 질환에서
편집많은 유전 질환은 수용체 유전자의 유전적 결함과 관련이 있다. 종종 수용체가 기능하지 않는지 또는 호르몬이 감소된 수준으로 생성되는지 판단하기가 어렵다. 이로 인해 내분비 장애의 "가상 저하" 그룹이 발생하는데, 여기서는 호르몬 수치가 감소한 것처럼 보이지만 실제로는 호르몬에 충분히 반응하지 않는 수용체로 인한 것이다.
면역계에서
편집면역계에서의 주요 수용체로는 패턴 인식 수용체(PRR), 톨 유사 수용체(TLR), 자연살해세포 활성화 수용체(KAR), 자연살해세포 면역글로불린 유사 수용체(KIR), 보체 수용체, Fc 수용체, B 세포 수용체, T 세포 수용체가 있다.[20]
같이 보기
편집주해
편집각주
편집- ↑ 가 나 다 Guyton, Arthur C.; Hall, John E. (2016). 《Guyton and Hall Textbook of Medical Physiology》. Philadelphia, PA: Elsevier Saunders. 930–937쪽. ISBN 9781455770052. OCLC 1027900365.
- ↑ Mihic, S. John; Harris, R. Adron (1997). “GABA and the GABAA Receptor”. 《Alcohol Health and Research World》 21 (2): 127–131. ISSN 0090-838X. PMC 6826832. PMID 15704348.
- ↑ 가 나 Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2014). 《Essential Cell Biology》 Four판. New York, NY, USA: Garland Science. 534쪽. ISBN 978-0-8153-4454-4.
- ↑ Gotti, Cecilia; Marks, Michael. J.; Millar, Neil S.; Wonnacott, Susan (2019년 9월 16일). “Nicotinic acetylcholine receptors (version 2019.4)”. 《IUPHAR/BPS Guide to Pharmacology CITE》 2019 (4). doi:10.2218/gtopdb/F76/2019.4. 2020년 11월 17일에 확인함.
- ↑ Malenka RC, Nestler EJ, Hyman SE (2009). 〈Chapter 9: Autonomic Nervous System〉. Sydor A, Brown RY. 《Molecular Neuropharmacology: A Foundation for Clinical Neuroscience》 2판. New York: McGraw-Hill Medical. 234쪽. ISBN 9780071481274.
Nicotine ... is a natural alkaloid of the tobacco plant. Lobeline is a natural alkaloid of Indian tobacco. Both drugs are agonists [of] nicotinic cholinergic receptors ...
- ↑ “Curare Drug Information, Professional”. 《Drugs.com》 (영어). 2018년 11월 16일에 원본 문서에서 보존된 문서. 2020년 12월 8일에 확인함.
- ↑ Congreve M, Marshall F (March 2010). “The impact of GPCR structures on pharmacology and structure-based drug design”. 《British Journal of Pharmacology》 159 (5): 986–96. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ↑ Qin K, Dong C, Wu G, Lambert NA (August 2011). “Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers”. 《Nature Chemical Biology》 7 (10): 740–7. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ↑ Zubay, Geoffrey (1998). 《Biochemistry 4th Ed.》. Dubuque, IA: William C Brown Pub. 684쪽. ISBN 0697219003.
- ↑ Garrett, Reginald; Grisham, Charles (2012). 《Biochemistry》. Cengage Learning. 1130쪽. ISBN 9781473733602.
- ↑ Hamm, Heidi E.; Oldham, William M. (2008). “Heterotrimeric G Protein Activation by G-Protein-Coupled Receptors”. 《Nature Reviews Molecular Cell Biology》 (Nature Publishing Group) 9 (1): 60–71. doi:10.1038/nrm2299. PMID 18043707. S2CID 24267759.
- ↑ 가 나 Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). 《Rang & Dale's Pharmacology》 7판. Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8.
- ↑ Milligan G (December 2003). “Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective”. 《Molecular Pharmacology》 64 (6): 1271–6. doi:10.1124/mol.64.6.1271. PMID 14645655. S2CID 2454589.
- ↑ Rang, HP (January 2006). “The receptor concept: pharmacology's big idea”. 《British Journal of Pharmacology》 147 (Suppl 1): S9–16. doi:10.1038/sj.bjp.0706457. PMC 1760743. PMID 16402126.
- ↑ Ariens EJ (September 1954). “Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory”. 《Archives Internationales de Pharmacodynamie et de Therapie》 99 (1): 32–49. PMID 13229418.
- ↑ Stephenson RP (December 1956). “A modification of receptor theory”. 《British Journal of Pharmacology and Chemotherapy》 11 (4): 379–93. doi:10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558. PMID 13383117.
- ↑ Silverman RB (2004). 〈3.2.C Theories for Drug—Receptor Interactions〉. 《The Organic Chemistry of Drug Design and Drug Action》 2판. Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7.
- ↑ Boulay G, Chrétien L, Richard DE, Guillemette G (November 1994). “Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state”. 《Endocrinology》 135 (5): 2130–6. doi:10.1210/en.135.5.2130. PMID 7956936.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 Boulpaep EL, Boron WF (2005). 《Medical Physiology: A Cellular and Molecular Approach》. St. Louis, Mo: Elsevier Saunders. 90쪽. ISBN 1-4160-2328-3.
- ↑ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). 《Immunology》. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 20쪽. ISBN 978-0-7817-9543-2.
외부 링크
편집- IUPHAR GPCR Database and Ion Channels Compendium 보관됨 2019-03-23 - 웨이백 머신
- Human plasma membrane receptome 보관됨 2019-09-15 - 웨이백 머신
- 의학주제표목 (MeSH)의 Cell+surface+receptors