안티모니
안티모니(←영어: Antimony 앤티머니[*]) 또는 안티몬(←독일어: Antimon 안티몬[*])은 화학 원소로 기호는 Sb(←라틴어: Stibium 스티비움[*])이고 원자 번호는 51이다. 준금속 원소인 안티모니는 네 가지 동소체가 존재한다. 가장 안정된 것은 청백색 금속 상태이다. 노란색과 검은색 안티모니는 불안정한 비금속이다. 안티모니는 방염성, 페인트, 세라믹, 에나멜, 합금, 전자 제품, 고무 등에 사용된다. 또한 안티모니의 플루오린화물인 오플루오린화 안티모니는 세상에서 가장 강력한 루이스 산이기도 하다. 안티모니 화합물은 고대로부터 알려져 있었으며 당시에는 주로 미용 용도로 쓰였다. 금속성의 안티모니도 꽤 오래 전부터 알려져 있었던 것으로 추정되나, 납과 혼동되는 일이 잦았다. 1540년 반노초 비링구초(Vannoccio Biringuccio)가 최초로 순수한 안티모니를 분리하였다.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Antimony | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | 121.760(1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 51 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 15족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 5주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | d-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 준금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
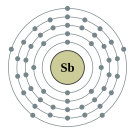
| 전자 배열 | [Kr] 4d10 5s2 5p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 준위별 전자 수 | 2, 8, 18, 18, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 금속성 백색, 노란색, 검은색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 903.78 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 1860 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 6.697 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 19.79 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 193.43 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 25.23 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | ±1 (약산성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 2.05 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 145 pm (실험값) 133 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 217 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 삼방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 (얇은 막대) | 3420 m/s (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 11.0 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 24.4 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 417 n Ω·m (0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | 반자성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 55 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 부피 탄성 계수 | 42 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | 3.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 굳기 | 294 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-36-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

특성
편집안티모니는 질소족(15족)에 속하며 전기음성도가 2.05이다. 주석이나 비스무트보다는 전기음성도가 높으나 텔루륨과 비소보다는 전기음성도가 낮다. 실온의 공기 중에서는 비교적 안정하지만 가열하면 산소와 반응하여 삼산화 안티모니를 생성한다. 산에는 부식 저항성이 있다. 안티모니는 은회색의 광택이 있는 금속으로 모스 굳기가 3이다. 순수한 안티모니는 무르기 때문에 단단한 물체를 만드는 데는 적합하지 않다. 일례로 1931년 중국에서 안티모니 동전을 발행한 적이 있었는데 동전의 마모가 너무 빠르게 진행되어 그 발행을 중단한 적이 있었다. 동위원소가 2종있다. 현재까지 네 종류의 안티모니 동소체가 알려져 있다. 하나는 안정한 금속성의 안티모니이고 나머지 세 가지는 준안정한 동소체이며, 각각 폭발성, 검은색, 노란색이다.
금속성 안티모니는 은백색 광택이 있는 부서지기 쉬운 형태이다. 용융된 안티모니를 천천히 냉각시키면 삼방정계로 결정화한다. 폭발성 안티모니는 비교적 희귀한 형태로, 삼염화 안티모니를 전기분해하여 얻는다. 날카로운 물체로 흠집을 내면 발열 반응이 일어나면서 금속성 안티모니로 전환되며, 막자와 막자사발을 이용해 빻으면 급격하게 연소한다. 흑색 안티모니는 기화한 금속성 안티모니를 급속하게 냉각시켜 얻는다. 결정 구조는 적린이나 흑색 비소와 같으며, 공기 중에서 산화하여 스스로 발화하기도 한다. 100°C에서는 점차 안정된 금속성 안티모니로 전환된다. 황색 안티모니는 가장 불안정한 동소체이다. -90°C에서 SbH3의 산화를 통해서만 생성되며, 그 이상의 온도나 빛에 노출되면 흑색 안티모니 형태로 되돌아간다.
동위 원소
편집안티모니는 두 종류의 안정한 동위 원소가 존재한다. 자연 상태에서 121Sb는 57.36%, 123Sb는 42.64% 존재한다. 이외에 총 35종류의 방사성 동위 원소가 발견되었으며, 이들 중 가장 반감기가 긴 것은 125Sb로 반감기가 약 2.75년이다.
존재
편집지각 속에는 안티모니가 0.2~0.5ppm 정도 함유되어 있는 것으로 추정된다. 이는 탈륨(약 0.5ppm)과 비슷한 수치이며, 은(0.07ppm)보다는 더 많이 함유된 것이다. 비록 지각 속에 풍부한 원소는 아니지만 약 100여 종류의 광석 속에서 안티모니가 발견된다. 이따금씩 순수한 형태로 발견되기도 하지만 대개는 황화물의 형태로 존재한다.
역사
편집황화 안티모니는 기원전 약 3100년 경 이집트 선왕조 시대부터 눈을 화장하는 데 쓰인 것으로 추정된다. 1540년 반노초 비링구초가 최초로 순수한 형태로 분류하고 이를 책에 묘사하였다. 15세기에 거울, 활자, 종 등에도 안티모니가 사용되었다는 기록이 존재한다. 1615년 독일 화학자 안드레아스 리바비우스는 용융된 안티모니 황화물과 몇 가지 염의 혼합물에 철을 첨가하여 안티모니 결정을 생성시켜 금속성 안티모니를 처음으로 발견하였다. 현재 중국에서 거의 90%에 육박하는 양이 생산되고 있으며, 남아프리카 공화국, 볼리비아, 러시아 등지에서도 채굴되고 있다.
용도
편집방염
편집생산된 안티모니의 약 60% 정도는 삼산화물 형태로 만들어져 방염 목적으로 사용된다. 대개 할로젠 방염 물질과 함께 사용된다. 이들의 반응으로 생성된 할로젠화 안티모니가 방염 역할을 한다.
합금
편집안티모니는 납과 혼합하면 강도가 증가하여 매우 유용한 합금이 된다. 납 이외에 다른 금속들과도 다양한 합금을 생성한다. 납 축전지에 안티모니를 첨가하면 수소 기체의 발생을 막을 수 있다.
고대 로마 제국 시대
편집안티몬은 로마 제국 때에 로마 귀족들이 구토제로 쓰이기도 했다.
성냥
편집성냥의 제조에도 사용되며 불꽃을 오래 지속하기 위해 삼황화 안티모니가 사용된다.
주의사항
편집안티모니 원소와 그 화합물은 대부분 유독하며, 중독 증상은 비소와 엇비슷하다. 대개는 비소보다 덜 유독하지만 일부 화합물은 극미량으로도 목숨을 빼앗는다. 세계보건기구에서는 식수 1리터 당 20μg을 최대 허용량으로 잡고 있다.
외부 링크
편집- “안티모니”. 《네이버캐스트》.
- (영어) 안티모니 - WebElements.com