타이타늄
타이타늄,(←영어: Titanium 타이테이니엄[*]) 또는 티탄(←독일어: Titan 티탄[*])은 화학 원소로 기호는 Ti(←라틴어: Titanium 티타니움[*])이고 원자 번호는 22이다. 가볍고 단단하며, 거의 부식되지 않는다. 전이 금속 원소로 은백색의 금속 광택이 있으며, 순수한 타이타늄은 낮은 물성치로 인해 강한 내식성이 요구되는 곳을 제외하고 대부분 합금으로 많이 쓰인다. 또한 이산화 타이타늄은 흰색 안료의 재료로, 페인트 등에 쓰인다.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Titanium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | 47.867(1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 4족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 4주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | d-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 전이 금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [Ar] 3d2 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
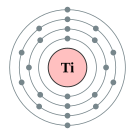
| 준위별 전자 수 | 2, 8, 10, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 금속성 은색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 1941 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 3660 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 4.506 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 14.15 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 425 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 25.060 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 4 (양쪽성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 1.54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 140 pm (실험값) 176 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 조밀 육방 격자 (hcp) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 (얇은 막대) | 5090 m/s (실온) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 8.6 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 21.9 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 0.420 μ Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | ??? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 116 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 부피 탄성 계수 | 110 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 푸아송 비 | 0.32 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 비커스 굳기 | 970 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 굳기 | 716 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7740-32-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
타이타늄은 여러 광물에 널리 분포하는데, 주로 티탄철석과 금홍석에서 얻는다. 두 가지 동소체와 다섯 가지 자연 동위 원소로 발견되며, 가장 흔한 것은 48Ti이다. 타이타늄의 가장 중요한 성질은 뛰어난 내식성과 비중이 낮아 강철 대비 무게는 60% 밖에 되지 않는다는 것이다. 타이타늄의 물리적, 화학적 성질은 지르코늄과 비슷하다.
발견
편집- 1791년 영국 아마추어 지질학자이자 목사인 William Gregor는 강가의 하천에서 타이타늄을 발견하고 ‘Manaccanite’로 명명하였다.
- 1795년 독일의 Martin H. Klaproth가 Rutile(금홍석)에서 타이타늄을 따로 추출해 ‘Titan’으로 명명하였다.
- 1797년 두 사람이 발견한 원소가 동일한 것으로 밝혀졌으며 영국에서는 ‘Titanium’ 독일에서는 ‘Titan’ 이라고 표기한다.
상용화
편집타이타늄은 지각을 구성하는 금속원소 중 9번째를 차지(지각 질량의 0.63%/출처:Google) 할 정도로 매장량이 풍부한 것에 비해 사용량이 적은 주요 원인은 TiO2가 주성분인 타이타늄 광물을 제련하기가 어렵기 때문이다. 즉, TiO2는 열역학적으로 매우 안정하여 환원하기가 어려우며 또한 타이타늄은 산소, 탄소, 질소, 수소 등과 친화력이 매우 크기 때문에 순수한 금속을 얻기도 어렵다. TiO2를 직접 환원하여 순수한 타이타늄 비금속을 얻는 것이 불가능하였기 때문에 발견된 이후 한참이 지나서야 타이타늄의 제련이 가능하게 되었다.
- 1910년에 미국의 M.A. Hunter는 철제 용기 내에서 TiCl4를 나트륨(Na)으로 환원하여 타이타늄을 제련하는데 성공하였으며 이는 Hunter Process 로 불리고 있다.
- 1932년에 룩셈부르크의 W.J. Kroll은 TiCl4와 칼슘(Ca)을 반응시켜 상당량의 타이타늄을 얻었으며,
- 1937년에는 TiCl4를 아르곤(Ar) 기체 속에서 마그네슘(Mg)으로 환원하여 스폰지 형ㅈ태의 타이타늄을 얻는데 성공하였고 이것이 오늘날 Kroll법의 시초다.
그 후 미국 광산국의 추진으로 Kroll법의 상용화가 이루어졌으며 마침내 1948년에 듀폰사에서 최초로 타이타늄을 상업적으로 생산하게 되었다. 현재에도 상업용 타이타늄은 거의 독점적으로 Kroll법에 의해 생산되고 있으며 지난 60년 동안 생산성 및 품질 측면에서 많은 개선을 이루어 왔다.
합금 종류
편집타이타늄 합금은 실온의 결정 구조에 의해 4가지 종류로 나뉘며, 시중에서는 ASTM 기준 등급으로 구분된다.
결정 구조에 따른 종류
편집- 순수타이타늄: 낮은 강도로 인해 강한 내식성이 요구 되는 곳 에서만 쓰인다.
- α 합금: 다름 합금보다 상온 강도가 낮으나 저온 안정상이므로 수 백도의 고온이 되어도 취약한 상을 석출할 염려가 없어서 내열 티탄합금의 기본이 된다. 알루미늄(Al), 주석(Sn), 지르코늄(Zr) 등을 첨가하여 α상을 고용 강화한 단일상이며
- α-β 합금: 가장 널리 사용되는 합금으로 Ti-6Al-4V 합금이 대표적인 합금이다. 강도는 122 ~ 97kgf/mm2 정도이고 높은 인성을 가지며, 소성 가공성, 용접성, 주조성도 좋아서 사용하기 쉽고 신뢰성이 큰 합금이다.
- β 합금: β형 합금은 V, Mo등의 β안정화 원소가 다량으로 첨가되는 합금으로 용체화 처리와 시효에 의해 130 kgf/mm2을 넘는 고강도를 얻을 수 있는 특징이 있지만 가공은 곤란해진다.
- 나노 타이타늄은 의학적인 목적으로 쓰인다.[1]
미국재료시험협회 기준 등급
편집| Grade1 | 순수타이타늄 | pure titanium |
| Grade2 | `` | `` |
| Grade3 | `` | `` |
| Grade4 | `` | `` |
| Grade5 | 합금 | Ti-6Al-4V |
| ... | `` | ... |
| ... | `` | ... |
| Grade28 | `` | Ti-3Al-5V-0.1Ru (Grade 9 with Ru) |
| ... | `` | ... |
| ... | `` | ... |
일반적 특징
편집- 비중이 작아 가볍다: 철의 절반 정도의 무게만으로도 철과 유사한 수준의 강도를 낼 수 있다.
- 뛰어난 내식성을 가진다: 상온 부근의 물 또는 공기 중에서는 부동태 피막이 형성되어 금이나 백금 다음 가는 우수한 내식성을 가진다.
- 녹는점이 약 1670 °C 정도로 매우 높아서 완전한 주괴 제작이 곤란하다.
- 고온에서는 급격히 산화되어 본래 요구되는 성질이 없어지기 때문에 열간 가공과 용접이 곤란하다.
- 높은 항복 응력 때문에 냉간 가공 또한 어렵다.
- 상온에서 안정한 산화피막이 생겨서 부식을 방지하지만 600 °C 이상의 고온에서는 반응성이 아주 좋아서 O2, N2, H2 등의 원소로 오염되어 내식성을 저하시키거나 용착 금속내부에 다공성 등의 결함을 발생시키게 되어 내식성 뿐만 아니라 기계적 성질까지 모두 저하시킨다.
대한민국
편집한국지질자원연구원은 2012∼2015년 강원도 태백시-삼척시-경상북도 봉화군의 경계에 위치한 면산(綿山, 1246.2 m) 일대를 탐사한 결과 조선 누층군 면산층에 대규모 타이타늄과 철이 있을 것으로 예상한 바 있다. 타이타늄의 예상 자원량은 8500만 t 이상일 것으로 추정된다.[2][3] 이곳의 지질은 면산을 중심으로 그 주변에 고생대 초기의 퇴적층 조선 누층군 태백층군이 하부로부터 캄브리아기의 조선 누층군 면산층, 묘봉층, 대기층, 세송층, 화절층과 오르도비스기의 동점층, 두무골층, 막골층, 직운산층, 두위봉층의 순서로 놓이며 이중 면산층에 타이타늄 광상(鑛床)이 분포한다. 면산층은 태백시 동점역 부근에 있는 동점 단층의 동쪽에 분포하는 지층으로 7 m 두께의 역암으로 이루어진 하부와 그 상위에 약 100 m 두께의 암회색 사암 및 실트암으로 이루어진 상부의 지층을 가리키며 이 지층은 조류가 우세한 조간대 환경에서 퇴적된 것으로 해석된다. 면산층의 타이타늄 함량을 조사한 결과 면산층의 평균 타이타늄 함량은 4.3%로 조선 누층군의 다른 지층에 비해 최소 10배 이상의 함량을 보인다. 그러나, 면산층의 타이타늄 함량은 최소 함량 0.51%에서 최대 함량 21.36%로 변이가 심하게 나타났으며, 이는 면산층 내의 타이타늄이 함유되는 사질(沙質) 암석과 이질(泥質) 암석이 교호 반복되는데 사질 부분은 이질 부분보다 타이타늄의 함량이 상대적으로 높기 때문이다.[4]
아래 표는 강원도 영월군과 태백시지역에 분포하는 조선 누층군 최하부 지층인 삼방산층과 면산층의 화학 성분표이다.[5] 삼방산층에 비해, 면산층에 이산화 티타늄의 함량이 더 높은 것을 봉 수 있다. 주요 원소 분석 결과, 철과 티타늄 산화광물(Fe2O3, TiO2)들의 함량이 면산층 시료에서 삼방산층 시료보다 높게 나타났다. 이는 박편 관찰시에 마그네타이트(magnetite)와 티탄철석(ilmenite) 등이 면산층에서 더 많이 관찰되었기 때문으로 보인다.
- 면산층과 삼방산층의 원소 함량 비교도
| 지층 | 태백시 면산층 | 영월군 삼방산층 | ||||||
|---|---|---|---|---|---|---|---|---|
| 시료 | MS 1 | MS 2 | MS 3 | MS 4 | SM 1 | SM 3 | SM 4 | SM 8 |
| 주요 성분 (%) | ||||||||
| 이산화 규소 | 76.52 | 51.97 | 63.89 | 68.74 | 66.84 | 58.27 | 82.34 | 73.02 |
| 산화 알루미늄 | 5.57 | 5.61 | 6.75 | 6.66 | 14.21 | 16.13 | 7.11 | 9.81 |
| 이산화 티타늄 | 2.88 | 10.84 | 5.43 | 2.96 | 0.87 | 1.14 | 0.50 | 0.50 |
| 산화 철(III) | 7.97 | 24.26 | 15.92 | 12.88 | 7.30 | 10.98 | 4.44 | 7.85 |
| 산화 망가니즈 | 0.28 | 0.30 | 0.09 | 0.14 | 0.02 | 0.03 | 0.08 | 0.05 |
| 산화 마그네슘 | 1.52 | 2.41 | 3.29 | 4.07 | 2.24 | 2.94 | 0.81 | 2.78 |
| 산화 칼슘 | 2.15 | 0.65 | 0.31 | 0.71 | 0.06 | 0.20 | 0.06 | 0.14 |
| 산화 나트륨 | 0.00 | 0.36 | 0.42 | 0.70 | 0.01 | 0.04 | 0.00 | 0.00 |
| 산화 칼륨 | 0.59 | 0.96 | 1.40 | 0.68 | 4.52 | 5.01 | 2.92 | 2.27 |
같이 보기
편집각주
편집- ↑ 임상수 (2010년 10월 18일). “냉전시대 무기 개발기술, 치료목적 재탄생”. 연합뉴스. 2010년 10월 21일에 확인함.
- ↑ “지질연, 민간 기업과 태백·삼척·봉화 타이타늄·철 광산 개발”. The Science Time. 2022년 4월 1일.
- ↑ “무려 8,500만 톤! 대규모 티타늄 광맥 발견”. YTN. 2023년 1월 16일.
- ↑ “분광분석과 기계학습기법을 활용한 조선누층군 타이타늄 함유 면산층 탐지”. 자원환경지질학회. 2022년.
- ↑ 황미경 (2011년). “강원도 영월과 태백지역에 분포하는 조선누층군 최하부층(삼방산층과 면산층)의 암석학적-지구화학적 비교분석”.
외부 링크
편집- “타이타늄”. 《네이버캐스트》.
- (영어) 타이타늄 - WebElements.com
- (영어) Trantixii - Designiging Titanium Archived 2017년 11월 12일 - 웨이백 머신