대사 증후군
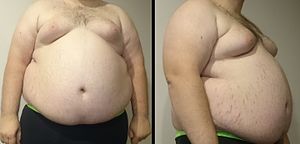
대사 증후군(代謝 症候群) 또는 메터볼릭 신드롬(영어: metabolic syndrome)은 복부비만(central obesity), 고혈압(hypertension, high blood pressure), 당뇨병 또는 고혈당(hyperglycemia), 과중성지방혈증(hypertriglyceridemia), 혈청 내 고밀도지질단백질(HDL) 저하 중 3개 이상일 경우에 해당한다.
 | |
|---|---|
| 다른 이름 | Dysmetabolic syndrome X |
 | |
| 진료과 | 내분비학 |
대사증후군은 심혈관질환(cardiovascular disease)과 2형당뇨병(Diabetes mellitus type 2, type 2 diabetes) 발달 위험과 관련되어 있다.[1][2] 미국에서 약 25%의 성인이 대사증후군이 있으며, 연령대가 높아질수록 비율도 높아지며, 특히 소수인종 및 소수민족 집단에서 더욱 그렇다.[3][4]
대사증후군, 인슐린 저항(Insulin resistance), 경계형당뇨병(prediabetes)은 서로 밀접하게 연관되어 있으며 중첩되는 부분도 있다. 대사증후군은 에너지 사용과 비축의 기저질환에 의하여 발생한다고 보고 있다. 대사증후군 원인은 지속적인 의학연구가 필요한 분야이다.
각종 심혈관 질환과 제2형 당뇨병의 위험 요인들이 서로 군집을 이루는 현상을 한 가지 질환군으로 개념화시킨 것이다. 인슐린 저항성(IR) 및 이와 관련된 복잡하고 다양한 여러 대사이상과 임상양상을 모두 포괄하여 설명할 수 있는 유용한 개념이다. 대사증후군을 방치하면, 동맥 경화, 심근 경색, 뇌졸중 등 심혈관 질환 혹은 제2형 당뇨병의 발병 위험도가 증가한다.
이 증상은 오래전부터 알려져 왔으나 1988년 제럴드 리븐(Gerald Reaven)은 이러한 증상들의 공통적인 원인이 체내의 인슐린 작용이 잘 되지 않는 인슐린 저항성임을 주장하고 '대사 증후군 X'(metabolic syndrome X), 'X 증후군'(syndrome X), '심장대사 증후군'(cardio-metabolic syndrome), '인슐린 저항성 증후군'(insulin resistance syndrome), '리븐 증후군'(Reaven's syndrome), '카오스'(CHAOS, 호주 의학계 한정)이라고 명명했다. 1998년 세계보건기구는 인슐린 저항성이 이 증상들의 모든 요소를 다 설명할 수 있다는 확증이 없기에 '인슐린 저항성 증후군'(IR syndrome)이라는 용어 대신 '대사 증후군'(메터볼릭 신드롬)으로 부르기로 했다.
징후 및 증상
편집대사증후군의 주요 징후는 복부비만(central obesity)이며, 또한 내장지방(visceral adiposity), 남성형비만(male-pattern adiposity), 사과형비만(apple-shaped adiposity)이기도 하다. 주로 허리와 몸통 주변에 지방조직(adipose tissue) 축적이 보이는 걸 특징으로 한다.[5] 또다른 징후로는 고혈압(high blood pressure), 공복 혈청(fasting serum)의 HDL 콜레스테롤(cholesterol) 저하, 공복 혈청의 트라이글리세라이드(triglyceride) 수치 상승, 공복 혈당치 상승(impaired fasting glucose), 인술린 저항(insulin resistance), 경계형당뇨병(prediabetes)이 있다. 관련 증상은 고요산혈증(hyperuricemia), 지방간(fatty liver)(특히 동시에 발생하는 비만)이 비알코올성 지방간질환(nonalcoholic fatty liver disease)으로 발전하는 것, 여성의 경우 다낭포성난소증후군(polycystic ovarian syndrome) 남성의 경우 발기부전(erectile dysfunction), 흑색극세포증(acanthosis nigricans)이 있다.
원인
편집대사증후군의 복잡한 경로의 기전은 연구중이다. 생리학적 변화(pathophysiology)는 매우 복잡하고 부분적으로만 설명이 되어 있다. 대부분은 연령이 높고 비만이며 좌식생활을 많이 하고 인슐린 저항이 있는 사람들이 걸린다. 스트레스 역시 요인이다. 가장 중요한 위험요인은 식단, 특히 설탕이 첨가된 음료,[6] 유전,[7][8][9][10] 연령, 좌식생활,[11] 신체활동 저하,[12][13] 생체주기나 수면 이상,[14] 기분장애나 향정신성약 복용,[15][16] 과도한 음주이다.[17] 과식과 그로 인한 지방독성(lipotoxicity)에서 발생하는 과도한 지방조직 확장이 대사증후군에서 수행하는 병원성 역할은 안토니오 비달-푸이그(Antonio Vidal-Puig)가 검토하였다.[18]
89,860명을 대상으로 한 코호트연구에서, 횡단면분석을 통하여 안정시 심박수(resting heart rate)와 대사증후군 간의 강력한 정적 연관성이 있다고 밝혀졌다. 중요하고 흥미로운 것은, 장기 연구를 통하여 대사증후군이 없지만 안정시 심박수가 높은 사람은 안정시 심박수가 낮은 사람에 비하여 장래에 대사증후군 발달 위험성이 더 큰 것으로 나타났다.[19]
비만이나 인슐린저항이 대사증후군 원인일지, 아니면 결과일지에 대하여서는 논란이 있다. C반응단백(C-reactive protein)을 포함한 전신 염증의 표지는, 피브리노겐(fibrinogen), 인터루킨 6(interleukin 6), 종양괴사인자 알파(tumor necrosis factor-alpha, TNF-α) 등과 마찬가지로 증가한다.
과당(fructose) 섭취로 인한 요산(uric acid) 증가 등 다양한 원인이 지적되기도 한다.[20][21][22]
연구는 신체에 생화학적으로 적합하지 않은 양의 음식 과소비 등 서구식 식습관이 대사증후군 발달의 요인이 된다고 보여준다.[23] 체중 증가는 대사증후군과 연관되어 있다. 대사증후군의 임상적 핵심 요소는 총지방이 아니라 내장지방과 이소성 지방(ectopic fat, 지방 저장을 위한 것이 아닌 것이 내장에 있는 지방)이지만, 주요 대사이상(metabolic abnormality)은 인슐린 저항이다.[24] 신체 활동이나 에너지 수요와 맞지 않게 탄수화물(carbohydrate), 지방(lipid), 단백질(protein) 섭취를 통한 끊임없는 에너지 공급은 미토콘드리아성 산화(mitochondrial oxidation)의 생산물의 비축을 낳게 되는데, 이는 미토콘드리아 기능부전이나 인슐린 저항으로 이어진다.
스트레스
편집최근 연구는 장기적 만성 스트레스(chronic stress)가 시상하부 뇌하수체 부신 축(hypothalamic-pituitary-adrenal axis, HPA-axis)의 호르몬 균형을 어지럽힘으로써 대사증후군을 일으킬 수 있다고 본다.[25] HPA축의 기능부전은 코르티솔(cortisol) 순환 수치를 야기하고, 포도당(glucose)과 인슐린(insulin) 수치를 높여서, 지방조직에 인슐린 매개 효과를(insulin-mediated effect)를 주고 결국에는 내장비만(visceral adiposity), 인슐린 저항, 이상지질혈증(dyslipidemia)과 고혈압을 일으키고, 뼈에도 영향을 주어 골교체(turnover, 오래된 골조직이 새로운 골조직으로 교체됨으로써 뼈를 유지하는 현상)가 느린 골다공증(osteoporosis)도 유발한다.[26] HPA축 기능부전은 복부비만이 심혈관계질환(cardiovascular disease, CVD), 제2형당뇨병(type 2 diabetes), 뇌졸중(stroke)의 지표가 되는 것을 설명한다.[27] 심리사회학적 스트레스(Psychosocial stress)는 심장질환으로도 이어진다.[28]
비만
편집허리둘레 증가로 인한 지방증가로부터 인슐린 저항이 발생하거나 인술린 저항으로 지방이 증가한다는 점에서, 복부비만은 대사증후군의 주요 특징으로, 징후이자 원인이 되기도 한다. 그러나 비만의 중요성에도 불구하고 정상체중 사람도 인슐린 저항으로 인하여 대사증후군이 있을 수 있다.[29]
좌식생활
편집신체활동이 없으면 심혈관계질환이 발생하게 되고 사망에 이르게 된다. 대사증후군 요소들은 좌식생활과 연관되어, 주로 복부쪽으로 지방조직이 증가하거나 HDL콜레스테롤이 줄어들거나 트라이글리세라이드, 혈압, 글루코스 증가를 가져온다. 하루 1시간 TV나 비디오를 보거나 컴퓨터를 사용하는 사람에 비하여, 4시간 이상 사용하는 사람이 대사증후군 위험이 2배 높다.[29]
노화
편집미국민 50세 이상에서는 60%가 대사증후군을 가지고 있다. 여성이 남성에 비해 대사증후군인 사람이 더 많다. 전세계 인구에 있어서도 고연령층의 대사증후군 비율이 높다.[29]
제2형당뇨병
편집대사증후군은 제2형 당뇨병 위험성을 5배 증가시킨다. 제2형당뇨병은 대사증후군의 합병증으로 간주된다.[30] 내당능장애(impaired glucose tolerance, IGT)의 이상이 있거나 공복 포도당 수치에 문제가 있는 사람에게는 대사증후군으로 인하여 제2형당뇨병 발병 위험이 2배 높다.[31] 경계형당뇨병과 대사증후군은 다른 생물학적 지표로 정의되는 같은 질병일 수 있다.
대사증후군은 대사증후군이 없는 제2형당뇨병이나 내당능장애(IGT) 환자보다 심혈관계질환 환자에게서 더 높은 관련성이 있다.[29] 저아포넥틴혈증(hypoadiponectinemia)은 인슐린 저항을 증가시키고[32] 대사증후군 위험요인으로 알려졌다.[33]
관상동맥 심장질환
편집관상동맥질환(coronary artery disease, CAD) 환자의 대사증후군 발병률은 50%이며, 45세의 관상동맥질환 전기 환자는, 특히 여성의 경우, 37%를 보였다. 적절한 심장재활(cardiac rehabilitation)과 영양, 신체활동, 체중감량, 약물치료 등 생활 변화를 통하여 대사증후군 증상을 금소시킬 수 있다.[29]
지질영양이상증
편집지질장애(lipodystrophic disorders)는 대사증후군과 관련 있다. 선천성전신지방이상증(Berardinelli-Seip congenital lipodystrophy, BSCL)이나 가족성부분지방이상증(Dunnigan familial partial lipodystrophy, DFPL)과 같은 유전성 형태, 강력 항레트로바이러스요법(highly active antiretroviral therapy)을 받은 환자의 HIV관련 지질영양이상증과 같은 후천성 형태는 심각한 인슐린 저항과 대사증후군 요소를 야기한다.[29]
류머티즘
편집합병증으로 류머티스에 관한 연구도 있다. 건선(psoriasis)과 건선성 관절염(psoriatic arthritis)도 대사증후군과 관련 있다고 밝혀졌다.[34]
생리학
편집내장지방(visceral fat)의 발달이 흔하게 되고, 이후 내장지방의 지방세포(adipocyte, fat cell)가 TNF-α의 혈장 수치를 증가시키고 아디포넥틴(adiponectin), 레시스틴(resistin), PAI-1 등의 물질 수치를 바꾸게 된다. TNF-α는 염증 사이토카인(cytokine)을 생성하고 인술린 저항을 야기하는 TNF-α 수용체(TNF-α receptor)와의 상호작용에 의한 세포신호(cell signaling)를 촉발할 수 있다.[35] 33%의 수크로스(sucrose)를 섭취한 쥐를 통한 실험은 대사증후군 발달 모델로 제안되어 왔다. 수크로스는 처음엔 트라이글리세라이드의 혈액 수치를 높였고 내장지방을 유도하고 인슐린 저항을 야기하였다. 내장지방이 TNF-α 증가와 인술린 저항으로 발전하는 것은 대사증후군 발달에 상응한 것으로 보았다. 지방조직 증가 역시 면역세포 수를 증가시키는데, 이는 염증에 있어 중요한 역할을 한다. 만성 염증은 고혈압, 죽상동맥경화증(atherosclerosis), 당뇨병의 위험을 증가시키는 원인을 제공하였다.[36]
체내 칸나비노이드 체계(endocannabinoid system, ECS)가 대사증후군 발달에 끼치는 영향은 반론의 여지가 없다.[37][38][39] 체내 칸나비노이드 과잉분비(endocannabinoid overproduction)는 보상체계(reward system) 기능저하를 가져올 수 있으며[38] 보상지연 할인(delay discounting) 이상 등 뇌기능장애(executive dysfunction)를 야기하기도 하며, 그 결과 건강하지 못한 행동이 영속된다. 두뇌는 대사증후군 발달에 중요하며 말초 탄수화물(peripheral carbohydrate)과 지방대사(lipid metabolism)를 조절한다.[37][38]
대사증후군은 수크로스나 과당의 과잉섭취와 이에 동반한 고지방식단으로 발생하기도 한다.[40] 그 결과 오메가-6 지방산(omega-6 fatty acids)의 과잉공급, 특히 아라키돈산(arachidonic acid, AA)은 대사증후군 발병의 중요 요인이다. 아라키돈산과 그것의 전구물질(precursor)인 리놀레산(linoleic acid)은 에이코사노이드(eicosanoid)라는 염증전달물질(inflammatory mediator) 생산의 기질(基質, substrate)로 작용하지만, 아라키돈산 포함 화합물인 다이글리세라이드(diglyceride, 혹은 디아실글리세롤diacylglycerol, DAG)는 체내칸나비노이드 2-AG(2-arachidonoylglycerol)의 전구물질이며, 지방산아미드가수분해효소(fatty acid amide hydrolase, FAAH)는 아난다미드(anandamide) 대사를 아라키돈산으로 매개한다.[41][39] 아난다미드는 몇몇 경로를 통하여 N-아실포스파티딜에탄올아민(N-Acylphosphatidylethanolamine)에서 생산되기도 한다.[39] 아난다미드와 2-AG는 아라키돈산으로 가수분해되기도 하고 에이코사노이드 합성(eicosanoid synthesis)을 증가시킬 수 있다.[39]
진단
편집국제당뇨병연합 유행병학 및 방지 TF팀(International Diabetes Federation Task Force on Epidemiology and Prevention), 미국립심장, 폐 및 혈액연구소(National Heart, Lung, and Blood Institute, NHLBI), 미국심장학회(American Heart Association), 세계심장연합(World Heart Federation), 국제죽상동맥경화증협회(International Atherosclerosis Society), 국제비만연구협회(International Association for the Study of Obesity)는 잠정적으로 공동으로 대사증후군 정의를 조합한 가이드라인을 출간하였다.[42] 이 정의에서는 특정 허리 측정에 관한 위험이 인구마다 다를 수 있다고 보았다. 어느 수준에서 위험수준이 시작되고 어느 수준에서 위험이 상당히 증가되었는지 정하는 것은 각 지역별 의사결정 집단에 달려 있다. 그러나 국제적 비교와 병인을 가능하게 하기 위하여, 전세계적으로 통용되는 기준을 사용하고 각 인종 및 성별 집단을 위한 통용 커트라인을 마련하는 것이 중요하다. 세계 혼혈인에 대하여서도 이에 대한 실용적인 결정이내려져야 한다. 따라서 과체중에 대한 국제 기준은, 지방조직, 뼈근육, 간에서의 과도한 지질저장으로부터 발생하는 대사증후군의 인체측정적 요소를 위한 복부비만의 인종적 특정 기준보다 더욱 적합하다.
대사증후군에 대한 국제당뇨병학회(International Diabetes Federation, IDF)[43]가 내린 이전 정의와 수정판 국제콜레스테롤교육프로그램(National Cholesterol Education Program, NCEP)은 매우 유사하며, 제시한 증상들을 가진 사람을 대사증후군 환자로 본다. 그러나 이들 간에는 두가지 차이점이 있다. IDF 정의로는 체질량지수(BMI)가 30kg/m2보다 크면, 복부비만으로 규정하며 허리둘레는 측정하지 않아도 된다. 그러나 BMI가 30 이하이면 허리둘레가 증가하지 읺은 대상자는 제외시킨다. 반면 NCEP 정의에서는 대사증후군이 다른 기준에 기반하여 진단된다. 또한 IDF에서는 허리둘레에 대한 지형 특정 차단점을 사용하지만, NCEP는 지형에 관계없이 허리둘레 차단점 한 세트만 사용한다.
IDF
편집국제당뇨병학회(International Diabetes Federation)[43]이 합의한 대사증후군 세계 정의(2006)에 따르면, 인종 특정적 수치를 반영한 허리둘레를 통해 정의되는 복부비만(BMI가 30kg/m2 이상이면 복부비만이라 하며 허리둘레를 잴 필요가 없다.)을 포함한 다음 두 가지 기준을 가지게 되면 대사증후군이라 한다.
- 트라이글리세라이드 증가 : > 150mg/dL (1.7mmol/L) 이상, 혹은 체지방 이상(lipid abnormality)에 대한 특정 치료
- HDL콜레스테롤 감소 : 남성은 40mg/dL(1.03mmol/L) 이하, 여성은 50mg/dL (1.29mmol/L) 이하, 혹은 체지방 이상(lipid abnormality)에 대한 특정 치료
- 혈압 증가 : 수축기 혈압 130mmHg 이상, 확장기 혈압 85mmHg 이상, 혹은 고혈압 치료 경력
- 공복 혈당(fasting plasma glucose, FPG) 증가 : 100mg/dL(5.6mmol/L) 이상, 혹은 제2형당뇨병 진단 경력
FPG가 5.6mmol/L 이상이거나 100mg/dL 이상이면, 구강내당능검사(oral glucose tolerance test, OGTT)가 권고되지만, 대사증후군 발현을 결정할 필요는 없다.
WHO
편집세계보건기구(World Health Organization, WHO)에서 1999년 마련한 정의[44]에 의하면, 진성당뇨병(diabetes mellitus), 내당능장애(impaired glucose tolerance), 공복혈당저하(impaired fasting glucose), 인슐린 저항 중 하나가 나타나고, 다음 아래 중 2개가 있을 경우를 대사증후군으로 본다.
- 혈압 140/90 mmHg 이상
- 이상지질혈증(Dyslipidemia) 트라이클리세라이드(TG) 1.695mmol/L 이상, HDL콜레스테롤 남성 0.9mmol/L 이하, 여성 1.0mmol/L 이하
- 복부비만 : 허리:엉덩이 비율(waist:hip ratio) 남성 0.90 이상, 여성 0.85 이상, 혹은 BMI 30kg/m2 이상
- 미세단백뇨(Microalbuminuria) : 요알부민배설율(urinary albumin excretion ratio) 20µg/min 이상 혹은 알부민:크레아틴 비율(albumin:creatinine ratio) 30mg/g 이상
EGIR
편집유럽인슐린저항연구그룹(European Group for the Study of Insulin Resistance) (1999)은 비당뇨병 환자에게서 공복 인슐린 수치 상위 25%로 정의하고, 다음 중 2대 이상인 경우를 인슐린 저항으로 정의하였다.
- 복부비만 : 남성 허리둘레 94cm 혹은 37인치 이상, 여성 80cm 혹은 31.5인치 이상
- 이상지질혈증 : TG 2.0mmol/L 이상 혹은 HDL-C 1.0mmol/L 이하, 혹은 이상지질혈증 치료중
- 혈압 140/90 mmHg 이랑 혹은 고혈압약 복용
- 공복 혈당(FPG) 6.1mmol/L 이상
NCEP
편집미국 국립콜레스테롤 교육프로그램(NCEP)이 제시한 진단 기준은 다음과 같다.
- 복부비만 : 허리 둘레 남성 102cm(동양인 90cm), 여성 88cm(동양인 85cm) 이상
- 중성지방 150mg/dL 이상
- 고밀도 콜레스테롤 : 남성 40mg/dL, 여성 50mg/dL 미만
- 공복 혈당 : 100mg/dL 이상 또는 당뇨병 치료 중
- 혈압 : 수축기 130mmHg 이상 또는 이완기 85mmHg 이상
5가지 지표 가운데 3가지 이상이 기준치를 넘으면 대사증후군으로 본다.
치료 및 예방
편집대사증후군은 심혈관질환의 위험과 당뇨병 발병의 위험을 증가시키므로 일단 진단이 되면 발병의 위험을 줄이기 위해 적극적인 치료에 나서야 한다. 일차적인 치료는 건강한 생활습관을 가지도록 하는 것으로 1년에 5~10%의 체중감량을 달성할 수 있도록 칼로리를 제한하고, 운동량을 증가시키며, 식단을 변화시켜야 한다. 생활습관의 개선만으로 충분치 않거나, 심혈관질환의 위험도가 매우 높은 경우에는 인슐린 증감제(Sensitizer)를 사용해 약물치료를 할 수 있다.
그러나 치료할 수 있는 뚜렷한 방법은 아직 밝혀지지 않았기 때문에 예방이 매우 중요하다. 비만이 가장 근본적인 원인이므로 적절한 체중 유지와 규칙적인 운동으로 예방해야 한다. 또한 스트레스를 받지 않도록 정신적ㆍ육체적 환경을 잘 조절해 마음을 편안하게 하는 것이 중요하다. 이를 예방하는 가장 좋은 방법은 바로 '운동'이다. 운동을 생활화하고, 술과 담배를 줄이는 것이 대사증후군을 예방하는 방법이다. 비만한 사람이 규칙적인 운동을 통해 체중을 줄이게 되면 신체의 인슐린 저항성이 개선될 뿐 아니라 이와 동반된 당뇨병이나 고혈압, 고지혈증 등의 증상도 호전될 수 있다는 것이 연구 결과를 통해 증명된 바 있다. 하루 30분 정도 걷기(1주에 150분 이상의 유산소 운동)나 가벼운 조깅은 체중을 줄이는 데 도움이 될 뿐 아니라 혈압 개선과 혈중 콜레스테롤 감소, 당뇨병 발생 위험을 줄이는 데 효과가 있다. 운동 중 가장 효과적인 방법으로는 복부를 중심으로 한 살빼기다. 허리둘레를 줄이면 내장비만의 위험성도 감소하고 이에 따라 대사증후군에 걸릴 확률도 줄어든다. 올바른 식사습관을 갖는 것도 중요하다. 우선 탄수화물 섭취는 전체 칼로리 중 50% 미만으로 낮추는 것이 좋다. 탄수화물은 단순 다당류의 탄수화물보다는 정제하지 않은 곡류로 만든 빵이나 식품, 현미가 좋으며 설탕은 정제하지 않은 비정제 사탕수수당이 좋다. 이를 통해 칼로리를 감소시키고 저지방을 유지해 복부비만을 방지할 수 있다. 규칙적인 운동이 병행돼야 함은 물론이다.
약물
편집대사증후군을 구성하는 증상들은 각각 치료된다.[45] 이뇨제(Diuretic)와 ACE 억제제(ACE inhibitor)는 고혈압 치료에 사용된다. 다양한 콜레스테롤약은 LDL콜레스테롤, 트라이글리세라이드, HDL콜레스테롤이 비정상일 때 사용된다.
식단
편집식단의 탄수화물 제한(carbohydrate restriction)은 혈당(blood glucose) 수치를 낮추고 체중 감량을 유도하며 대사증후군 처방약을 줄일 수 있다.[46]
유행병학
편집세계 성인 인구 중 약 20–25%가 대사증후군의 위험요인 클러스터를 가지고 있다.[43] 2000년 약 32%의 미국 성인이 대사증후군을 가지고 있다.[47][48] 최근 이 수치는 34%까지 올랐다.[48][49]
고위험군(high risk)을 지칭하는 연령 특정 차단점 및 참고치가 제대로 마련되어 있지 않기에 어린이 대사증후군 측정 방식에 대한 합의된 기준은 없다.[50] 이어지는 심혈관계 위험 요약 스코어(cardiometabolic risk summary score)는 대사증후군의 이분법적 측정을 대신하여 아동용으로 사용된다.[51]
진단기준의 제한점
편집'증후군'이란 공통적인 병인을 가지고 다양한 증상과 임상소견으로 표현되는 표현할 때 사용하는 용어이다. 하지만 대사증후군은 인슐린저항성이 가장 중요한 병적요인이지만 아직까지 각 진단기준 요소들의 공통적인 병인이라고 할 수 없다. 따라서 대사증후군만을 위한 특별한 치료방법이 없고, 진단기준 요소들 각각에 대한 예방 혹은 치료로만 대사증후군을 예방 혹은 치료 할 수 있다. 현재의 진단기준이 모호하거나 불완전하고 진단기준치에 대한 근거가 명확하지 않다. 현재의 각종 진단기준은 기준치가 장기적인 전향적 연구결과에 의한 것이 아닌 전문가 진단의 합의에 의해 이루어진 인위적인 것이라는 결정적인 한계 때문이다. 복부 비만, 고혈압, 혈당장애, 고중성지방, 낮은 HDL콜레스테롤[52]이라는 5가지 중 3가지가 한꺼번에 나타나는 현상이 일어나는 증상을 대사 증후군으로 정의한다. 이는 현재 대사증후군의 진단기준을 이루는 각 위험 인자들의 위험도가 동일하지 않기 때문에 이러한 진단에는 제한이 있다. 하지만 환자로 하여금 각종 심혈관 질환 위험요인들의 군집성 개념을 이해하는 데 도움이 되고, 병인과 관련된 각종 기초연구를 활성화시키는 등의 역할을 하기도 한다.[53]
같이 보기
편집질병
편집- 갑상선기능저하증
- 고혈압(hypertension)
- 괴혈병 & 비타민 C
- 뇌졸중(stroke)
- 당뇨병(diabetes)
- 만성 신부전(CKD) - 신부전 & 부신
- 만성 피로 증후군(CFS), 생활습관병, 췌장암
- 멜라스 증후군
- 발기부전(erection dysfunction)
- 복부비만, 복수 (질병)
- 심혈관질환(cardiovascular disease)
- 암 & 저체온증
- 인슐린 저항(insulin resistance)
- 저나트륨혈증(염분 결핍)
- 지방간(fatty liver)
- 혈관성 치매
물질
편집- 마그네슘 - 인슐린 민감성(IS) VS 인슐린 저항성(IR)
- 사포닌, 진세노사이드, 엘루테로사이드(en:Eleutheroside)
- 오메가-3 지방산 VS 오메가-6 지방산 VS 오메가-9 지방산, 포화 지방산
- 요산
- 종양괴사인자 알파(tumor necrosis factor-alpha, TNF-α)
- 카페인, 디카페인, 보리 커피 - 대사질환자들에게는 카페인이 좋지 않으므로 디카페인 음료가 권장됨
- 콜레스테롤
- 트리메틸라민-N-산화물(en:Trimethylamine N-oxide, TMAO)
- 폴리코사놀(policosanol)
- 피트산(en:Phytic acid, IP6), 이노시톨, 발아현미, 감마 아미노뷰티르산(GABA)
- AMP-활성단백질키나제
기타
편집각주
편집- ↑ Kaur J (2014). “A comprehensive review on metabolic syndrome”. 《Cardiology Research and Practice》 2014: 1–21. doi:10.1155/2014/943162. PMC 3966331. PMID 24711954.
- ↑ Felizola, Saulo JA (2015). “Ursolic acid in experimental models and human subjects: Potential as an anti-obesity/overweight treatment?”. doi:10.13140/RG.2.1.4502.4804.
- ↑ Falkner B, Cossrow ND (July 2014). “Prevalence of metabolic syndrome and obesity-associated hypertension in the racial ethnic minorities of the United States”. 《Current Hypertension Reports》 16 (7): 449. doi:10.1007/s11906-014-0449-5. PMC 4083846. PMID 24819559.
- ↑ Beltrán-Sánchez H, Harhay MO, Harhay MM, McElligott S (August 2013). “Prevalence and trends of metabolic syndrome in the adult U.S. population, 1999–2010”. 《Journal of the American College of Cardiology》 62 (8): 697–703. doi:10.1016/j.jacc.2013.05.064. PMC 3756561. PMID 23810877.
- ↑ “Metabolic Syndrome”. 《Diabetes.co.uk》. 2019년 1월 15일.
- ↑ Malik VS, Popkin BM, Bray GA, Després JP, Willett WC, Hu FB (November 2010). “Sugar-sweetened beverages and risk of metabolic syndrome and type 2 diabetes: a meta-analysis”. 《Diabetes Care》 33 (11): 2477–83. doi:10.2337/dc10-1079. PMC 2963518. PMID 20693348.
- ↑ Pollex RL, Hegele RA (September 2006). “Genetic determinants of the metabolic syndrome”. 《Nature Clinical Practice Cardiovascular Medicine》 3 (9): 482–89. doi:10.1038/ncpcardio0638. PMID 16932765. S2CID 24558150.
- ↑ Poulsen P, Vaag A, Kyvik K, Beck-Nielsen H (May 2001). “Genetic versus environmental aetiology of the metabolic syndrome among male and female twins”. 《Diabetologia》 44 (5): 537–43. doi:10.1007/s001250051659. PMID 11380071. S2CID 26582450.
- ↑ Groop, Leif (2007). “Genetics of the metabolic syndrome”. 《British Journal of Nutrition》 83: S39–S48. doi:10.1017/S0007114500000945. PMID 10889791.
- ↑ Bouchard C (May 1995). “Genetics and the metabolic syndrome”. 《International Journal of Obesity and Related Metabolic Disorders》. 19 Suppl 1: S52–59. PMID 7550538.
- ↑ Edwardson CL, Gorely T, Davies MJ, Gray LJ, Khunti K, Wilmot EG, Yates T, Biddle SJ (2012). “Association of sedentary behaviour with metabolic syndrome: a meta-analysis”. 《PLOS ONE》 7 (4): e34916. Bibcode:2012PLoSO...734916E. doi:10.1371/journal.pone.0034916. PMC 3325927. PMID 22514690.
- ↑ Katzmarzyk PT, Leon AS, Wilmore JH, Skinner JS, Rao DC, Rankinen T, Bouchard C (October 2003). “Targeting the metabolic syndrome with exercise: evidence from the HERITAGE Family Study”. 《Medicine and Science in Sports and Exercise》 35 (10): 1703–09. doi:10.1249/01.MSS.0000089337.73244.9B. PMID 14523308.
- ↑ He D, Xi B, Xue J, Huai P, Zhang M, Li J (June 2014). “Association between leisure time physical activity and metabolic syndrome: a meta-analysis of prospective cohort studies”. 《Endocrine》 46 (2): 231–40. doi:10.1007/s12020-013-0110-0. PMID 24287790. S2CID 5271746.
- ↑ Xi B, He D, Zhang M, Xue J, Zhou D (August 2014). “Short sleep duration predicts risk of metabolic syndrome: a systematic review and meta-analysis”. 《Sleep Medicine Reviews》 18 (4): 293–97. doi:10.1016/j.smrv.2013.06.001. PMID 23890470.
- ↑ Vancampfort D, Correll CU, Wampers M, Sienaert P, Mitchell AJ, De Herdt A, Probst M, Scheewe TW, De Hert M (July 2014). “Metabolic syndrome and metabolic abnormalities in patients with major depressive disorder: a meta-analysis of prevalences and moderating variables”. 《Psychological Medicine》 44 (10): 2017–28. doi:10.1017/S0033291713002778. PMID 24262678.
- ↑ Vancampfort D, Vansteelandt K, Correll CU, Mitchell AJ, De Herdt A, Sienaert P, Probst M, De Hert M (March 2013). “Metabolic syndrome and metabolic abnormalities in bipolar disorder: a meta-analysis of prevalence rates and moderators”. 《The American Journal of Psychiatry》 170 (3): 265–74. doi:10.1176/appi.ajp.2012.12050620. PMID 23361837.
- ↑ Sun K, Ren M, Liu D, Wang C, Yang C, Yan L (August 2014). “Alcohol consumption and risk of metabolic syndrome: a meta-analysis of prospective studies”. 《Clinical Nutrition》 33 (4): 596–602. doi:10.1016/j.clnu.2013.10.003. PMID 24315622.
- ↑ Vidal-Puig, Antonio (2013). “Adipose tissue expandability, lipotoxicity and the metabolic syndrome”. 《Endocrinologia Y Nutricion: Organo De La Sociedad Espanola De Endocrinologia Y Nutricion》. 60 Suppl 1: 39–43. doi:10.1016/s1575-0922(13)70026-3. ISSN 1579-2021. PMID 24490226.
- ↑ Jiang X, Liu X, Wu S, Zhang GQ, Peng M, Wu Y, Zheng X, Ruan C, Zhang W (Jan 2015). “Metabolic syndrome is associated with and predicted by resting heart rate: a cross-sectional and longitudinal study”. 《Heart》 101 (1): 44–9. doi:10.1136/heartjnl-2014-305685. PMID 25179964. S2CID 11325211.
- ↑ Nakagawa T, Hu H, Zharikov S, Tuttle KR, Short RA, Glushakova O, Ouyang X, Feig DI, Block ER, Herrera-Acosta J, Patel JM, Johnson RJ (March 2006). “A causal role for uric acid in fructose-induced metabolic syndrome”. 《American Journal of Physiology. Renal Physiology》 290 (3): F625–31. doi:10.1152/ajprenal.00140.2005. PMID 16234313.
- ↑ Hallfrisch J (June 1990). “Metabolic effects of dietary fructose”. 《FASEB Journal》 4 (9): 2652–60. doi:10.1096/fasebj.4.9.2189777. PMID 2189777. S2CID 23659634.
- ↑ Reiser S, Powell AS, Scholfield DJ, Panda P, Ellwood KC, Canary JJ (May 1989). “Blood lipids, lipoproteins, apoproteins, and uric acid in men fed diets containing fructose or high-amylose cornstarch”. 《The American Journal of Clinical Nutrition》 49 (5): 832–39. doi:10.1093/ajcn/49.5.832. PMID 2497634.
- ↑ Bremer AA, Mietus-Snyder M, Lustig RH (March 2012). “Toward a unifying hypothesis of metabolic syndrome”. 《Pediatrics》 129 (3): 557–70. doi:10.1542/peds.2011-2912. PMC 3289531. PMID 22351884.
- ↑ Ali ES, Hua J, Wilson CH, Tallis GA, Zhou FH, Rychkov GY, Barritt GJ (September 2016). “The glucagon-like peptide-1 analogue exendin-4 reverses impaired intracellular Ca(2+) signalling in steatotic hepatocytes”. 《Biochimica et Biophysica Acta (BBA) - Molecular Cell Research》 1863 (9): 2135–46. doi:10.1016/j.bbamcr.2016.05.006. PMID 27178543.
- ↑ Gohil BC, Rosenblum LA, Coplan JD, Kral JG (July 2001). “Hypothalamic-pituitary-adrenal axis function and the metabolic syndrome X of obesity”. 《CNS Spectrums》 6 (7): 581–86, 589. doi:10.1017/s1092852900002121. PMID 15573024.
- ↑ Tsigos C, Chrousos GP (October 2002). “Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress”. 《Journal of Psychosomatic Research》 53 (4): 865–71. doi:10.1016/S0022-3999(02)00429-4. PMID 12377295.
- ↑ Rosmond R, Björntorp P (February 2000). “The hypothalamic-pituitary-adrenal axis activity as a predictor of cardiovascular disease, type 2 diabetes and stroke”. 《Journal of Internal Medicine》 247 (2): 188–97. doi:10.1046/j.1365-2796.2000.00603.x. PMID 10692081. S2CID 20336259.
- ↑ Brunner EJ, Hemingway H, Walker BR, Page M, Clarke P, Juneja M, Shipley MJ, Kumari M, Andrew R, Seckl JR, Papadopoulos A, Checkley S, Rumley A, Lowe GD, Stansfeld SA, Marmot MG (November 2002). “Adrenocortical, autonomic, and inflammatory causes of the metabolic syndrome: nested case-control study”. 《Circulation》 106 (21): 2659–65. doi:10.1161/01.cir.0000038364.26310.bd. PMID 12438290. S2CID 5992769.
- ↑ 가 나 다 라 마 바 Fauci, Anthony S. (2008). 《Harrison's principles of internal medicine》. McGraw-Hill Medical. ISBN 978-0-07-147692-8.
- ↑ “Metabolic syndrome”. Mayo Clinic. 2020년 9월 10일에 확인함.
- ↑ Goldberg RB, Mather K (September 2012). “Targeting the consequences of the metabolic syndrome in the Diabetes Prevention Program”. 《Arteriosclerosis, Thrombosis, and Vascular Biology》 32 (9): 2077–90. doi:10.1161/ATVBAHA.111.241893. PMC 3901161. PMID 22895669.
- ↑ Lara-Castro C, Fu Y, Chung BH, Garvey WT (June 2007). “Adiponectin and the metabolic syndrome: mechanisms mediating risk for metabolic and cardiovascular disease”. 《Current Opinion in Lipidology》 18 (3): 263–70. doi:10.1097/MOL.0b013e32814a645f. PMID 17495599. S2CID 20799218.
- ↑ Renaldi O, Pramono B, Sinorita H, Purnomo LB, Asdie RH, Asdie AH (January 2009). “Hypoadiponectinemia: a risk factor for metabolic syndrome”. 《Acta Medica Indonesiana》 41 (1): 20–24. PMID 19258676.
- ↑ Quilon, Augusto; Brent, Lawrence (2010). “The primary care physician's guide to inflammatory arthritis: diagnosis”. 《The Journal of Musculoskeletal Medicine》 27: 223–31.
- ↑ Hotamisligil GS (June 1999). “The role of TNFalpha and TNF receptors in obesity and insulin resistance”. 《Journal of Internal Medicine》 245 (6): 621–25. doi:10.1046/j.1365-2796.1999.00490.x. PMID 10395191. S2CID 58332116.
- ↑ Whitney, Ellie and Ralfes, R. Sharon. 2011. Understanding Nutrition. Wadsworth Cengage Learning: Belmont, CA
- ↑ 가 나 Gatta-Cherifi, Blandine; Cota, Daniela (2015). 〈Endocannabinoids and Metabolic Disorders〉. 《Endocannabinoids》. Handbook of Experimental Pharmacology 231. 367–91쪽. doi:10.1007/978-3-319-20825-1_13. ISBN 978-3-319-20824-4. PMID 26408168.
The endocannabinoid system (ECS) is known to exert regulatory control on essentially every aspect related to the search for, and the intake, metabolism and storage of calories, and consequently it represents a potential pharmacotherapeutic target for obesity, diabetes and eating disorders. ... recent research in animals and humans has provided new knowledge on the mechanisms of actions of the ECS in the regulation of eating behavior, energy balance, and metabolism. In this review, we discuss these recent advances and how they may allow targeting the ECS in a more specific and selective manner for the future development of therapies against obesity, metabolic syndrome, and eating disorders.
- ↑ 가 나 다 Vemuri VK, Janero DR, Makriyannis A (March 2008). “Pharmacotherapeutic targeting of the endocannabinoid signaling system: drugs for obesity and the metabolic syndrome”. 《Physiology & Behavior》 93 (4–5): 671–86. doi:10.1016/j.physbeh.2007.11.012. PMC 3681125. PMID 18155257.
The etiology of many appetitive disorders is characterized by a pathogenic component of reward-supported craving, be it for substances of abuse (including alcohol and nicotine) or food. Such maladies affect large numbers of people as prevalent socioeconomic and healthcare burdens. Yet in most instances drugs for their safe and effective pharmacotherapeutic management are lacking despite the attendant medical needs, collateral adverse physical and psychological effects, and enormous global market potential. The endocannabinoid signaling system plays a critical role in motivational homeostasis as a conduit for reward stimuli and a positive modulator of brain reward circuits. Endocannabinoid-system hyperactivity through CB1 receptor transmission is considered contributory to a range of appetitive disorders and, hence, is a major focus of contemporary pharmaceutical research.
- ↑ 가 나 다 라 Turcotte C, Chouinard F, Lefebvre JS, Flamand N (June 2015). “Regulation of inflammation by cannabinoids, the endocannabinoids 2-arachidonoyl-glycerol and arachidonoyl-ethanolamide, and their metabolites”. 《Journal of Leukocyte Biology》 97 (6): 1049–70. doi:10.1189/jlb.3RU0115-021R. PMID 25877930. S2CID 206999921.
- ↑ Fukuchi S, Hamaguchi K, Seike M, Himeno K, Sakata T, Yoshimatsu H (June 2004). “Role of fatty acid composition in the development of metabolic disorders in sucrose-induced obese rats”. 《Experimental Biology and Medicine》 229 (6): 486–93. doi:10.1177/153537020422900606. PMID 15169967. S2CID 20966659.
- ↑ Di Marzo V, Fontana A, Cadas H, 외. (Dec 1994). “Formation and inactivation of endogenous cannabinoid anandamide in central neurons”. 《Nature》 (Submitted manuscript) 372 (6507): 686–91. Bibcode:1994Natur.372..686D. doi:10.1038/372686a0. PMID 7990962. S2CID 4341716.
- ↑ Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, Fruchart JC, James WP, Loria CM, Smith SC (October 2009). “Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity” (PDF). 《Circulation》 120 (16): 1640–45. doi:10.1161/CIRCULATIONAHA.109.192644. PMID 19805654.
- ↑ 가 나 다 Alberti, George; Zimmet, Paul; Shaw, Johnathan (2006). Grundy, Scott M., 편집. IDF Consensus Worldwide Definition of the Metabolic Syndrome (PDF) (보고서). Brussels, Belgium: International Diabetes Federation. 2012년 9월 16일에 원본 문서에서 보존된 문서.
- ↑ Alberti, KGMM; Zimmet (1999). “Definition, Diagnosis, and Classification of Diabetes Mellitus and its Complications” (PDF). World Health Organization. 32–33쪽. 2014년 8월 21일에 원본 문서 (PDF)에서 보존된 문서. 2013년 3월 25일에 확인함.
- ↑ Srikanthan, K; Feyh, A; Visweshwar, H; Shapiro, J. I; Sodhi, K (2016). “Systematic Review of Metabol ic Syndrome Biomarkers: A Panel for Early Detection, Management, and Risk Stratification in the West Virginian Population”. 《International Journal of Medical Sciences》 13 (1): 25–38. doi:10.7150/ijms.13800. PMC 4716817. PMID 26816492.
- ↑ Feinman, R. D; Pogozelski, W. K; Astrup, A; Bernstein, R. K; Fine, E. J; Westman, E. C; Accurso, A; Frassetto, L; Gower, B. A; McFarlane, S. I; Nielsen, J. V; Krarup, T; Saslow, L; Roth, K. S; Vernon, M. C; Volek, J. S; Wilshire, G. B; Dahlqvist, A; Sundberg, R; Childers, A; Morrison, K; Manninen, A. H; Dashti, H. M; Wood, R. J; Wortman, J; Worm, N (2015). “Dietary carbohydrate restriction as the first approach in diabetes management: Critical review and evidence base”. 《Nutrition》 31 (1): 1–13. doi:10.1016/j.nut.2014.06.011. PMID 25287761.
- ↑ Ford ES, Li C, Zhao G (September 2010). “Prevalence and correlates of metabolic syndrome based on a harmonious definition among adults in the US”. 《Journal of Diabetes》 2 (3): 180–93. doi:10.1111/j.1753-0407.2010.00078.x. PMID 20923483. S2CID 5145131.
- ↑ 가 나 Ford ES, Giles WH, Mokdad AH (October 2004). “Increasing prevalence of the metabolic syndrome among u.s. Adults”. 《Diabetes Care》 27 (10): 2444–49. doi:10.2337/diacare.27.10.2444. PMID 15451914.
- ↑ Mozumdar A, Liguori G (January 2011). “Persistent increase of prevalence of metabolic syndrome among U.S. adults: NHANES III to NHANES 1999-2006”. 《Diabetes Care》 34 (1): 216–19. doi:10.2337/dc10-0879. PMC 3005489. PMID 20889854.
- ↑ Kamel, M.; Smith, B. T.; Wahi, G.; Carsley, S.; Birken, C. S.; Anderson, L. N. (2018년 9월 17일). “Continuous cardiometabolic risk score definitions in early childhood: a scoping review: Cardiometabolic risk definitions”. 《Obesity Reviews》 19 (12): 1688–1699. doi:10.1111/obr.12748. PMID 30223304. S2CID 52291692. 2020년 11월 17일에 확인함.
- ↑ Chiarelli, Francesco; Mohn, Angelika (October 2017). “Early diagnosis of metabolic syndrome in children”. 《The Lancet Child & Adolescent Health》 1 (2): 86–88. doi:10.1016/S2352-4642(17)30043-3. PMID 30169210. 2020년 11월 17일에 확인함.
- ↑ “잔병없던 뚱보男, 갑자기 혀 꼬이고 반신 마비”. 동아일보. 2013년 8월 19일. 2013년 8월 19일에 확인함.
- ↑ 권혁상 외, 대사증후군의 최신지견, BioWave Vol. 9 No. 2 2007
외부 링크
편집- 대사증후군 Archived 2007년 10월 9일 - 웨이백 머신
- 스포츠칸 '당뇨병, 관리가 치료다'